Los detalles técnicos: Química
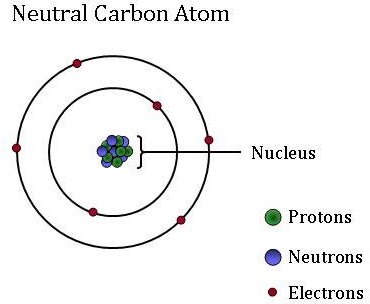
Los átomos, que son la unidad básica y fundamental de toda la materia, pueden diferir mucho entre sí. Aunque los átomos son demasiado pequeños para verlos sin usar microscopios de alta potencia, están compuestos de partículas aún más pequeñas: protones, neutrones y electrones.
Los electrones, que son partículas extremadamente ligeras con carga negativa, orbitan alrededor de una masa central, el núcleo de un átomo. Los átomos pueden ganar o perder electrones, que cambian la carga del átomo (creando iones). Sin embargo, el átomo sigue siendo el mismo elemento, ya sea que tenga una carga positiva, negativa o neutral.
El núcleo (o centro) pequeño y denso del átomo contiene los otros componentes, los protones y neutrones. Los protones son partículas cargadas positivamente, y el número de protones siempre se fija para un elemento en particular. En otras palabras, el número de protones es lo que le da a cada elemento su identidad única e individual. Por ejemplo, un átomo de carbono tiene seis protones, pero un átomo con solo cinco protones es boro, mientras que un átomo con siete protones es el elemento nitrógeno.
Los neutrones son neutrales-no tienen cargo. Los isótopos son átomos del mismo elemento que tienen un número diferente de neutrones. Aunque los isótopos del mismo elemento son gemelos cuando se trata de reactividad, el diferente número de neutrones significa que tienen una masa diferente. Ciertos isótopos son más abundantes en algunos materiales que en otros, ya que algunos procesos físicos y químicos «prefieren»un isótopo sobre otro. Estas diferencias en la abundancia isotópica se utilizan como» etiquetas » para identificar las diferentes fuentes de CO2 encontradas en una muestra de CO2 atmosférico. Los científicos atmosféricos de la NOAA usan estas etiquetas isotópicas para determinar qué porcentaje de ese carbono se derivó de combustibles fósiles, la biosfera terrestre o el océano.
Isótopos de carbono
Los isótopos de carbono vienen en tres formas. Con mucho, el isótopo de carbono más común es el carbono-12 (12C), que contiene seis neutrones además de sus seis protones. El siguiente isótopo de carbono más pesado, el carbono-13 (13C), tiene siete neutrones. Tanto el 12C como el 13C se denominan isótopos estables, ya que no se desintegran en otras formas o elementos con el tiempo. El raro isótopo de carbono-14 (14C) contiene ocho neutrones en su núcleo. A diferencia del 12C y el 13C, este isótopo es inestable o radiactivo. Con el tiempo, un átomo de 14C se descompondrá en un producto estable.

La gran mayoría de todo el carbono encontrado en la Tierra es de 12C. Casi el 99% de todo el carbono en la Tierra es de esta forma. Mientras que solo aproximadamente el 1% de todo el carbono en la Tierra es de la forma isotópica 13C, el 14C sigue siendo mucho más raro. Solo uno de cada trillón de átomos de carbono es 14C.
Para tener una idea de cuán pocos átomos de 14C hay en comparación con 12C, comparemos uno a un billón. Un trillón es un millón de millones. Si alinearas un billón de billetes de un dólar, ¡se extendería casi desde la Tierra hasta el sol!