i kjemi er anekvivalenspunkt et begrep som brukes under titrering. Det gjeldertil enhver syre-base eller nøytraliseringsreaksjon teknisk.
Definisjon:
ekvivalenspunktet til en kjemisk reaksjon er punktet hvor like mengder reaktanter blandes kjemisk.
med andre ord, mens titrering, er det et punkt hvor mengden tilsatt titrant er nok til å nøytralisere analytteløsningen helt. Antall mol titrant dvs. standard løsning er lik molene av en løsning som har en ukjent konsentrasjon. Det er også kjent som det støkiometriske punktet fordi det er et punkt hvor molene av syre er lik molene av basen som trengs for å nøytralisere løsningen. Vær oppmerksom på at syre til base-forholdet ikke trenger å være 1:1. Dette syre-base-forholdet forklares av den balansert syre-base kjemiske ligningen. Indikatorer kan brukes til dette formålet, for eksempel metylorange eller fenolftalein.

ekvivalenspunktet kan ikke tas på samme måte som endepunktet for en titrering. Endepunktet henvises til som det punktet hvor den brukte indikatoren endrer fargen. Disse fargeendringer vises etter å ha nådd ekvivalenspunktet. Hvis vi bruker endpoint for å bestemme ekvivalens, vil det forårsake en feil.
Metoderav Å Bestemme Ekvivalenspunktet:
det er forskjelligemetoder for bestemmelse av ekvivalenspunktet. De diskuteres somfølger:
- pH-indikator
- Konduktans
- Fargeendring
- Nedbør
- Isotermisk kalorimetri
- Termometrisk titrimetri
- Spektroskopi
- Amperometri
ph-indikator:
Aph-Indikator Er Et Kjemisk Stoff Som Endrer Fargen I Reaksjon På Noenkjemisk Endring. En syrebaseindikator, for eksempel fenolftalein endresfargen som avhenger av pH. Redoksindikatorer kan også brukes til detteformål. I utgangspunktet legges bare en enkelt dråpe indikatorløsning tilitrering. Endringen i farge vil vise at endepunktet er oppnådd.Dette vil være en estimering av ekvivalenspunktet.
Konduktans:
Den Elektriske ledningsevne av en løsning påvirkes av ioner. Derfor endres ledningsevne når de reagerer med hverandre. (for eksempel, mens utfører en syre-base titrering, H3O+, OG OH – ioner reagerer og formnøytral vann, H20 løsning). Konduktans er relativt en vanskelig metode foroperere, spesielt når ioner som er tilstede i løsningen kandelta i ledningsevne. Konduktans kan brukes til noen syre-basereaksjoner.
Fargeendring:
påekvivalenspunktet, vil løsningen endre fargen naturlig uten noentillegg av en indikator i noen reaksjoner. Dette kan observeres i overgangsperiodenmetaller hvor oksidasjonstilstanden består av forskjellige farger.
Nedbør:
under titrering vil bunnfallet dannes hvisreaksjonen danner et fast stoff. Et godt eksempel på nedbør er reaksjonenmellom sølv, Ag+ Og Klor, Cl-som resulterer i dannelsen av aninsoluble salt, Sølvklorid, AgCl. Uventet, dette gjør det svært vanskelig å bestemme endepunktene nøyaktig på grunn av partikkelstørrelse, frekvensen ofsedimentation og farge gjør det svært vanskelig å se. Dette er grunnen til at nedfallstitrering gjøres som tilbaketitreringer.
Isotermisk Kalorimetri:
Bestemmelse av ekvivalenspunktet gjøres ved å beregne mengden varme som produseres eller absorberes ved å bruke en enhet kjent som et isotermisk titreringkalorimeter. Denne typen brukes vanligvis i titreringer som involverer biokjemiskreaksjoner dvs. som enzymbinding.
Termometrisk Titrimetri:
Termometrisk Titrimetri er en usedvanlig mangefasettert teknikk. Her bestemmes ekvivalenspunktet ved å måle hastigheten på temperaturendring produsert ved achemisk reaksjon. Denne egenskapen skiller den fra kalorimetrisktitrimetri. Fordi termometrisk titrimetri er en relativ teknikk, er det ikkenødvendig å utføre titreringen under isotermiske forhold. Denne typentitrering kan utføres i plast eller til og med i glassbeholdere. For å forhindre utkast, er disse fartøyene vanligvis omsluttet ved å forårsake støy som forstyrrer endepunktet. På grunn av evnen til denne typen titrering å bli utført under omgivende forhold, er de egnet for rutinemessig prosess og kvalitetskontroll i bransjen. Temperaturen vil enten øke ellerreduksjon under titreringsprosessen, avhengig av om reaksjonen som tar sted mellom titrant og analytt er eksoterm eller endoterm. Ittitrering når all analytt har blitt konsumert av reaksjonen, endres frekvensen av temperaturen, dvs. en økning eller reduksjon bestemmer ekvivalensenpunkt og bøyning i temperaturkurven kan observeres. Ekvivalenspunktet kan observeres nøyaktig ved å benytte det andre derivatet av temperaturkurven. Programvaren som brukes i et moderne automatisertermometrisk titreringssystem består av vanlige avanserte digitale algoritmerslik at støyen som genererer fra svært følsomme temperaturprober, ikke forårsaker noen forstyrrelse av utseendet til en vanlig, jevn sekundderivativ topp som beskriver endepunktet. Denne teknikken har evnen tilveldig høy presisjon og varianskoeffisienten (CVs) på mindre enn 0,1 arevanlig. De siste termometriske titreringstemperaturprober har en termistorsom danner en arm Av En Wheatstone-bro. det beste termometriske titreringssystemet kan løse temperaturen til 10-5 K hvis det er koblet til høyoppløsningselektronikk. Hvis temperaturen endres mens du utfører titrering bli alitt som 0,001 K en skarp ekvivalens punkt vil bli oppnådd. Hvor det er anenthalpy endring, kan denne teknikken brukes nødvendigvis til enhver kjemisk reaksjoni en væske, selv om reaksjonskinetikken spiller en viktig rolle i beregningskarpheten av endepunktet. Dette punktet med titrimetri har blitt betydeligpåført syrebase, EDTA, REDOKS og utfellingstitrering. Viktigeksempler på nedbørstitrering inkluderer:
- Sulfattitrering Med Bariumioner
- Fosfattitrering Med Magnesium i ammoniumoppløsning
- Kloridtitrering med sølvnitrat
- Nickeltitrering Med Dimetylglyoksim
- Fluoridtitrering Med Aluminium (som K2NaAlF6)
Asnon-vandige titreringer kan enkelt utføres som vandig titrering fordi temperaturproben ikke krever å være elektrisk forbundet med løsningen som det kreves i potensiometriske titreringer. Løsninger som ersvært uklar eller farget kan enkelt analyseres av termometrisk uten noenvidere behandling av en prøve. Sonden er vedlikeholdsfri. Nå en dag ved å bruke de nyeste og svært pr@cised stepper motordrevne burettene,er termometriske titreringer fullført innen få minutter, noe som gjør denne teknikken til et perfekt valg der høy produksjon i et laboratorium er nødvendig.
Spektroskopi:
denne typen spektroskopi brukes til å bestemme ekvivalenspunktet hvis spektrumet av reaktanten, produktet eller titranten er kjent. En bestemt mengde av produktetog reaktant brukes til å finne ekvivalenspunktet. Et svært lavt nivå avfri titrants tilstedeværelse kan også bestemmes. Kort sagt, denne metoden brukesfor å bestemme eksistensen av halvledere.
Amperometri:
Amperometrier en deteksjonsteknikk som brukes til å måle endringen i gjeldende.Amperometri brukes mest i de titreringene der overskytende titrant kan reduseres. Denne metoden er nyttig når du titrerer et halogenid med Ag+ fordi dannelsen av utfellinger ikke vil bli påvirket.
Eksempler på ekvivalenspunkt:
- reaksjonen av en sterk syre med en sterk base:
la anta saltsyre HCl (en sterk syre) er tatt som en analytt og natriumhydroksyd NaOH (sterk base) er tatt som en titrant. Hvis vi plotter en graf mellom analytt pH og en titrant NaOH som kan legges fra buretten, vil en titrering graf bli dannet som er gitt nedenfor:
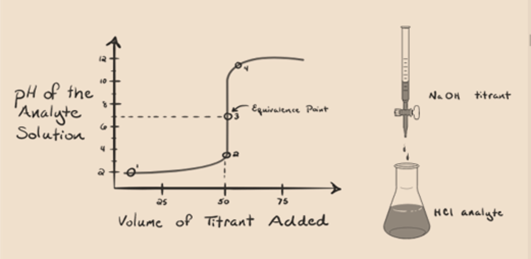
Figur 1.1
ovennevnte figur 1.1 viser ved punkt 1 at når ingen base Som NaOH er lagt til. PH i analytten er lav da den for det meste inneholder H3O+ fra separasjonen Av HCl.

som natriumhydroksid NaOH er lagt dråpe bydrop, det begynner å bli absorbert AV OH-sakte som er produsert avdissosiasjon Av NaOH. Den produserte analytten vil være sur på grunn av den dominerendetilstedeværelse av hydroniumioner, H3O+.
i figur 1.1 punkt 2 indikerer tidspunktet hvor pH registreres like før nøytraliseringen finner sted helt. Mens punkt 3 viser oss ekvivalenspunktet. Her er molene tilsatt natriumhydroksyd lik molene av hydroksylkloridet i analytten. Dette er punktet hvor hydroniumioner, H3O+, er fullstendig nøytralisert av hydroksylion, OH–. Ph i løsningen er nøytral, dvs. pH = 7 fordi den har salt, NaCl OG vann H2O.
Punkt 4 i figur 1.1 viser at når Vi fortsetter å legge Til NaOH, begynner ph i løsningen å bli grunnleggende på grunn av fullstendig nøytralisering Av HCl. NÅ er det nok AV OH-ioner er til stede i løsningen som dissosierer Fra NaOH.
- reaksjonen av en svak syre med en sterk base:
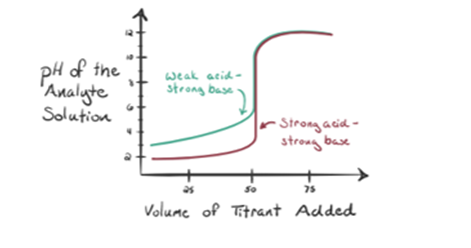
la oss vurdere en svak syre, en eddiksyre CH3COOH Og en sterk base natriumhydroksyd NaOH Som titrant. Hvis vi plotter en graf mellom ph av analytten og volumet Av NaOH, vil Vi få en titreringskurve som vist nedenfor.
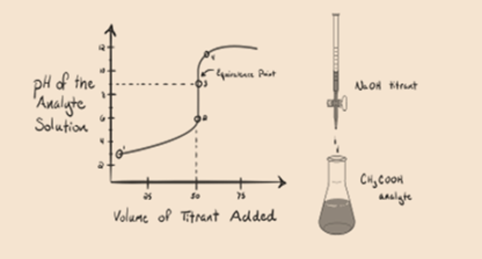
Figur 1.2
Figur 1.2 viser ved punkt 1 At NaOH ikke er lagt til ennå, så akkurat nå er ph av analytten lav da den for det meste inneholder H3O+ når CH3COOH dissosierer. Men som eddiksyre er en svak syre, vil den i utgangspunktet være høyere.

Aswe holder på å legge NaOH dråpevis, H3O+ vil begynne å gettingconsumed AV OH-sakte. Dette vil bli produsert ved dissosiasjonen avnaoh. Men her er analytten fortsatt sur på grunn av TILSTEDEVÆRELSEN AV H3O+ – ioner for det meste.
Infigure 1.2 punkt 2 indikerer pH registrert om gangen like før aneutralisering finner sted helt.
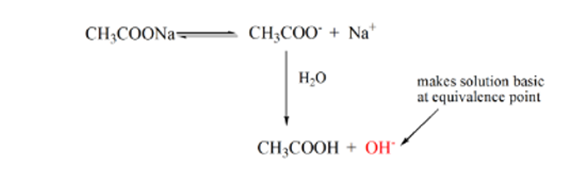
Punkt 3 representerer ekvivalenspunktet. Dette er punktet hvor mol NaOH er lik molene CH3COOH i en analytt. Hydroniumioner er fullstendig nøytralisert av hydroksylioner. Løsningen vil da inneholde CH3COONa salt OG H2O.

Merk:
Du Kan merke en forskjell her i forhold til en sak 1 med a ha en strongacid titrert mot en sterk base. I dette tilfellet (svak syre og en sterkbase) er pH ikke nøytral ved et ekvivalenspunkt. Løsningen er å ha en pH ~ 9 ved ekvivalenspunktet. La oss finne ut årsaken nedenfor.
fra ovennevnte ligning er det vist at løsningen inneholder CH3COONa ved ekvivalenspunktet. Dette dissosierer til en natriumion og acetationer. Acetation er den konjugerte basen AV den svake syre CH3COOH. Derfor ER CH3COO– relativt en sterk base (dvs. svak syre har en sterk konjugatbase) derfor reagerer DE med vann for å produsere hydroksidioner som øker pH til nær 9 ved ekvivalenspunktet.
Punkt 4 i figur 1.2 viser at når natriumhydroksid er i større mengde, vil den oppnådde titreringskurven være identisk Med HCl-NaOH.
- Sterksyre med svak base:
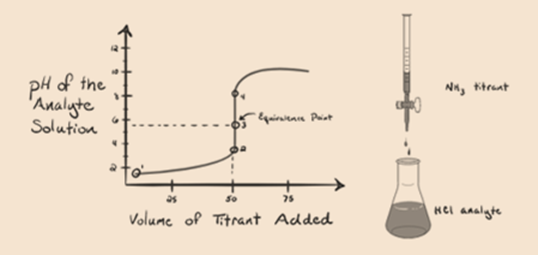
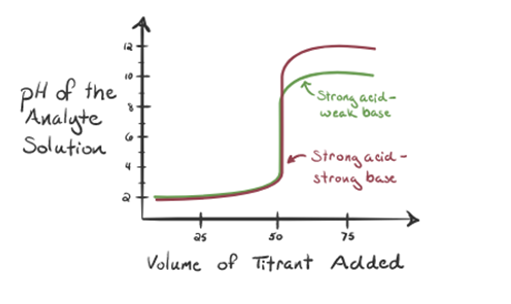
her, la oss vurdere saltsyre som en sterk syre som en analytt og ammoniakk som en svak base som titrant. Hvis vi plotter en graf mellom ph i analyttoppløsningen og volumet av titranten NH3, vil vi få en titreringskurve som gitt nedenfor:
Figur 1.3
i figur 1.3 punkt 1 viser at når ingen ammoniakk tilsettes, ph av analytt vil være lav som det meste inneholder H3O+ fra dissosiasjon Av Saltsyre.
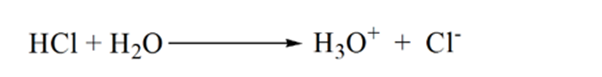
som ammoniakk legges dråpe for dråpe, begynner H3O+ å bli fortært av ammoniakk sakte. Analytten vil fortsatt være sur på grunn AV flertallet AV H3O+ – ioner.
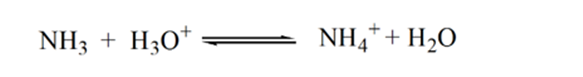
Punkt2 i figur 1.3 indikerer at pH registreres på et punkt like før aneutralisering finner sted helt.
Punkt3 viser ekvivalenspunktet. Her er antall mol tilsatt Nh3er lik molene HCl i analytten. Hydroniumioner er fullenøytraliserte AV NH3.
Merk:
Itis la merke til at i tilfelle av den svake basen mot en sterk syre er phikke nøytral ved ekvivalenspunktet. Derfor er løsningen som oppnåsvil være sur med en pH rundt 5,5 ved ekvivalenspunktet.
årsaken til dette er at ved et ekvivalenspunkt har løsningen bare ammoniumioner NH4 + Og Kloridioner, CL-. Som ammoniumioner er konjugatsyren av en svak base, DVS. NH3. DERFOR ER NH4 + en sterk syre, OG DERMED VIL NH4 + reagere med vann for å produsere hydroniumioner som gjør løsningen sur.
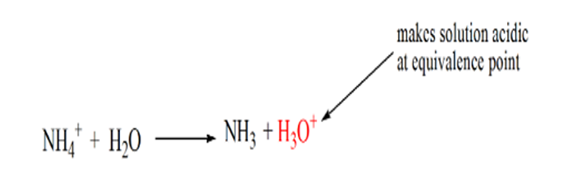
Punkt 4 viser at etter å ha oppnådd et ekvivalenspunkt, vil vi fortsette å legge til ammoniakk og når det er over, vil pH begynne å øke. Ammoniakk er en svak base slik at pH er over 7, men det som lavere i forhold Til en sterk base NaOH vist i tilfelle 1.
- Svakbase med svak syre:
la oss vurdere ammoniakk, en svak base som en analytt og en eddiksyre som er en svak syre som titrant. Hvis vi plotter en graf mellom ph i analyttoppløsningen versus volumet av eddiksyre som titrant, vil vi få en titreringskurve som nedenfor:
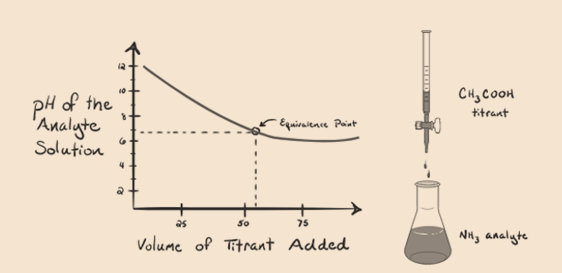
Figur 1.4
Vi Har lagt merke til At det ikke er bratt i denne grafplottet. Dette er det vi kaller et «bøyningspunkt» på ekvivalenspunktet. Fraværet av den nødvendige bratte endringen i pH gir oss ikke mye informasjon gjennom en slik kurve.