moleculele sau ionii care pot dona sau accepta un proton, în funcție de circumstanțele lor, se numesc specii amfiprotice. Cea mai importantă specie amfiprotică este apa în sine. Când un acid donează un proton în apă, molecula de apă este un acceptor de protoni și, prin urmare, o bază. În schimb, atunci când o bază reacționează cu apa, o moleculă de apă donează un proton și, prin urmare, acționează ca un acid.
un alt grup important de specii amfiprotice este aminoacizii. Fiecare moleculă de aminoacizi conține o grupare carboxil acidă și o grupare amino bazică. De fapt, aminoacizii există de obicei în zwitterion (germană pentru „ion dublu”) formă, unde protonul s-a transferat de la carboxil la gruparea amino. În cazul glicinei, de exemplu, zwitterionul este
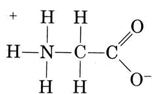
zwitterion poate dona unul dintre protonii din N, la fel cum un ion NH4+ poate dona un proton. Pe de altă parte, COO– end– ul său poate accepta un proton, la fel cum poate un CH3COO-ion. Other common amphiprotic species are HCO3–, H2PO4–, HPO42–, and other anions derived from diprotic or triprotic acids.