moleculen of ionen die een proton kunnen doneren of accepteren, worden amphiprotische species genoemd. De belangrijkste amfiprotische soort is water zelf. Wanneer een zuur een proton aan water doneert, is het watermolecuul een protonacceptor, en dus een base. Omgekeerd, wanneer een base reageert met water, een watermolecuul doneert een proton, en dus fungeert als een zuur.
een andere belangrijke groep amphiprotic species zijn de aminozuren. Elk aminozuurmolecuul bevat een zure carboxylgroep en een basisaminogroep. In feite bestaan de aminozuren gewoonlijk in zwitterion (Duits voor “dubbel ion”) vorm, waar het proton van carboxyl aan de aminogroep is overgegaan. In het geval van glycine, bijvoorbeeld, is het zwitterion
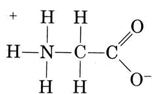
het zwitterion kan één van de protonen uit de N doneren, net zoals een NH4 + – ion een proton kan doneren. Aan de andere kant kan zijn COO– einde een proton accepteren, net zoals een CH3COO– ion dat kan. Other common amphiprotic species are HCO3–, H2PO4–, HPO42–, and other anions derived from diprotic or triprotic acids.