passiivinen Kuljetus
jotta voidaan ymmärtää, miten aineet liikkuvat passiivisesti solukalvon poikki, on ymmärrettävä pitoisuusgradientit ja diffuusio. Konsentraatiogradientti on aineen konsentraatioero tilan välillä. Molekyylit (tai ionit) leviävät/hajaantuvat siitä, missä ne ovat keskittyneempiä, sinne, missä ne ovat vähemmän keskittyneitä, kunnes ne jakautuvat tasaisesti kyseiseen tilaan. (Kun molekyylit liikkuvat tällä tavalla, niiden sanotaan liikkuvan alaspäin pitoisuusgradienttiään.) Kolme yleistä passiivisen kuljetuksen tyyppiä ovat yksinkertainen diffuusio, osmoosi ja helpotettu diffuusio.
yksinkertainen diffuusio on hiukkasten siirtymistä suuremman konsentraation alueelta pienemmän konsentraation alueelle. Muutama yhteinen esimerkki auttaa havainnollistamaan tätä käsitettä. Kuvittele olevasi suljetussa kylpyhuoneessa. Jos hajuvesipulloa suihkutettaisiin, hajumolekyylit leviäisivät luonnollisesti pullon jättöpaikasta kylpyhuoneen kaikkiin nurkkiin, ja tämä diffuusio jatkuisi, kunnes pitoisuusgradienttia ei enää olisi. Toinen esimerkki on lusikallinen sokeria, joka on asetettu teekuppiin. Lopulta sokeri hajaantuu koko teehen, kunnes pitoisuusgradienttia ei ole jäljellä. Kummassakin tapauksessa, jos huone on lämpimämpi tai tee kuumempi, diffuusio tapahtuu vielä nopeammin molekyylien törmätessä toisiinsa ja levittäytyessä nopeammin kuin viileämmissä lämpötiloissa. Kun kehon sisälämpötila on noin 98,6° f, se auttaa myös hiukkasten diffuusiossa kehossa.
käy tästä linkistä nähdä diffuusio ja miten se liikkuu kineettisen energian molekyylien liuoksessa. Miten lämpötila vaikuttaa diffuusionopeuteen ja miksi?
aina kun aine on suuremmassa pitoisuudessa puoliperimättömän kalvon, kuten plasmakalvon, toisella puolella, mikä tahansa aine, joka voi siirtää pitoisuusgradienttiään alaspäin kalvon poikki, tekee niin. Tarkastellaan aineita, jotka voivat helposti diffuusi läpi lipidikerroksen solukalvon, kuten kaasut happi (O2) ja CO2. O2 yleensä diffundoituu soluihin, koska se on enemmän keskittynyt niiden ulkopuolelle, ja CO2 tyypillisesti diffundoituu ulos soluista, koska se on enemmän keskittynyt niiden sisälle. Kumpikaan näistä esimerkeistä ei vaadi Solulta mitään energiaa, ja siksi ne käyttävät passiivista kuljetusta siirtyäkseen kalvon yli. Ennen kuin siirryt eteenpäin, sinun täytyy tarkastella kaasuja, jotka voivat levitä solukalvon poikki. Koska solut käyttävät nopeasti happea aineenvaihdunnan aikana, on tyypillisesti pienempi pitoisuus O2 solun sisällä kuin ulkopuolella. Tämän seurauksena happi diffuusi interstitiaalinesteestä suoraan kalvon lipidikerroksen läpi solussa olevaan sytoplasmaan. Toisaalta, koska solut tuottavat CO2: ta aineenvaihdunnan sivutuotteena, CO2-pitoisuudet nousevat sytoplasmassa; siksi CO2 siirtyy solusta lipidikaksikon kautta interstitiaalinesteeseen, jossa sen pitoisuus on pienempi. Tämä molekyylien leviämismekanismi, jossa ne ovat keskittyneempiä sinne, missä ne ovat vähemmän keskittyneitä, on passiivinen kuljetusmuoto, jota kutsutaan yksinkertaiseksi diffuusioksi (Kuva 3.15).
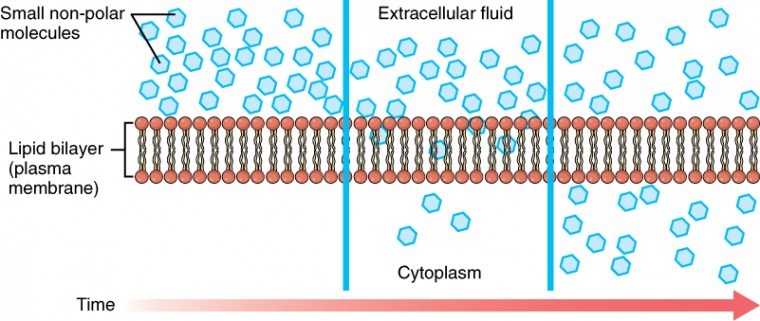
Kuva 3.15. Yksinkertainen diffuusio solukalvon (Plasma) läpi lipidikaksikon rakenne sallii vain pienten, ei-polaaristen aineiden, kuten hapen ja hiilidioksidin, kulkea solukalvon läpi konsentraatiogradienttiaan alaspäin yksinkertaisella diffuusiolla.
osmoosi on veden diffuusiota puoliperäisen kalvon läpi (Kuva 3.16). Vesi voi liikkua vapaasti kaikkien solujen solukalvon poikki joko proteiinikanavien kautta tai liukumalla itse kalvon lipidihäntien väliin. Se on kuitenkin pitoisuus liuosten sisällä vettä, joka määrittää, onko vesi siirtyy soluun, ulos solusta, tai molemmat.

Kuva 3.16. Osmoosi osmoosi on veden diffuusio puolipermeikkisen kalvon läpi alas sen konsentraatiogradienttia. Jos kalvo läpäisee vettä, joskaan ei liukosellua, vesi tasaa Oman konsentraationsa diffusoimalla pienemmän vesipitoisuuden puolelle (ja siten korkeamman liukosellun puolelle). Vasemmalla olevassa dekantterilasissa kalvon oikealla puolella oleva liuos on hypertoninen.
liuokset liuoksessa luovat osmoottisen paineen, paineen, joka vetää vettä. Osmoosi tapahtuu, kun on epätasapaino liuosten ulkopuolella solun vs. solun sisällä. Mitä enemmän liuosta sisältää, sitä suurempi osmoottinen paine liuoksella on. Liuoksen, jossa on suurempi pitoisuus liuenneita kuin toisessa liuoksessa, sanotaan olevan hypertoninen. Vesimolekyylit pyrkivät diffundoitumaan hypertoniseksi liuokseksi, koska korkeampi osmoottinen paine vetää vettä (Kuva 3.17). Jos solu sijoitetaan hypertoniseen liuokseen, solut näivettyvät tai krenatoituvat veden poistuessa solusta osmoosin avulla. Sen sijaan sellaisen liuoksen, jossa on vähemmän liuenneita aineita kuin toisessa liuoksessa, sanotaan olevan hypotoninen. Hypotonisessa liuoksessa olevat solut ottavat liikaa vettä ja turpoavat, jolloin riski lopulta puhkeamisesta on lysis. Elollisten homeostaasin kriittinen näkökohta on luoda sisäinen ympäristö, jossa kaikki kehon solut ovat isotonisessa liuoksessa, ympäristö, jossa kahdella liuoksella on sama pitoisuus liuenneita aineita (yhtä suuri osmoottinen paine). Kun solut ja niiden solunulkoiset ympäristöt ovat isotonisia, vesimolekyylien konsentraatio on sama solujen ulkopuolella ja sisällä, joten vesi virtaa sekä sisään että ulos ja solut säilyttävät normaalin muotonsa (ja toimintansa). Eri elinjärjestelmät, erityisesti munuaiset, toimivat tämän homeostaasin ylläpitämiseksi.

Kuva 3.17. Liuosten konsentraatio hypertonisella liuoksella on toista liuosta suurempi liukenemakonsentraatio. Isotonisen liuoksen liuotuspitoisuus on yhtä suuri kuin toisen liuoksen. Hypotonisen liuoksen liuotuspitoisuus on pienempi kuin toisen liuoksen.