passiv Transport
för att förstå hur ämnen rör sig passivt över ett cellmembran är det nödvändigt att förstå koncentrationsgradienter och diffusion. En koncentrationsgradient är skillnaden i koncentration av ett ämne över ett utrymme. Molekyler (eller joner) kommer att sprida/diffundera från var de är mer koncentrerade till var de är mindre koncentrerade tills de är lika fördelade i det utrymmet. (När molekyler rör sig på detta sätt sägs de flytta ner sin koncentrationsgradient.) Tre vanliga typer av passiv transport inkluderar enkel diffusion, osmos och underlättad diffusion.
enkel Diffusion är rörelsen av partiklar från ett område med högre koncentration till ett område med lägre koncentration. Ett par vanliga exempel hjälper till att illustrera detta koncept. Tänk dig att vara inne i ett slutet badrum. Om en flaska parfym sprayades skulle doftmolekylerna naturligt diffundera från den plats där de lämnade flaskan till alla hörn av badrummet, och denna diffusion skulle fortsätta tills ingen mer koncentrationsgradient kvarstår. Ett annat exempel är en sked socker placerad i en kopp te. Så småningom kommer sockret att diffundera genom teet tills ingen koncentrationsgradient kvarstår. I båda fallen, om rummet är varmare eller teet varmare, sker diffusion ännu snabbare när molekylerna stöter på varandra och sprider sig snabbare än vid svalare temperaturer. Att ha en inre kroppstemperatur runt 98,6 kcal f hjälper således också till diffusion av partiklar i kroppen.
Besök denna länk för att se diffusion och hur den drivs av molekylernas kinetiska energi i lösning. Hur påverkar temperaturen diffusionshastigheten, och varför?
när ett ämne finns i större koncentration på ena sidan av ett semipermeabelt membran, såsom plasmamembranet, kommer varje ämne som kan röra sig ner sin koncentrationsgradient över membranet att göra det. Tänk på ämnen som lätt kan diffundera genom lipid-dubbelskiktet i cellmembranet, såsom gaserna syre (O2) och CO2. O2 diffunderar vanligtvis i celler eftersom det är mer koncentrerat utanför dem, och CO2 diffunderar vanligtvis ut ur celler eftersom det är mer koncentrerat inuti dem. Inget av dessa exempel kräver någon energi från cellens sida, och därför använder de passiv transport för att röra sig över membranet. Innan du går vidare måste du granska de gaser som kan diffundera över ett cellmembran. Eftersom celler snabbt använder syre under ämnesomsättningen finns det vanligtvis en lägre koncentration av O2 inuti cellen än utanför. Som ett resultat kommer syre att diffundera från interstitiellvätskan direkt genom membranets lipid-dubbelskikt och in i cytoplasman i cellen. Å andra sidan, eftersom celler producerar CO2 som en biprodukt av ämnesomsättningen, ökar CO2-koncentrationerna i cytoplasman; därför kommer CO2 att röra sig från cellen genom lipiddubbelskiktet och in i interstitialvätskan, där dess koncentration är lägre. Denna mekanism av molekyler som sprider sig från där de är mer koncentrerade till där de är mindre koncentration är en form av passiv transport som kallas enkel diffusion (figur 3.15).
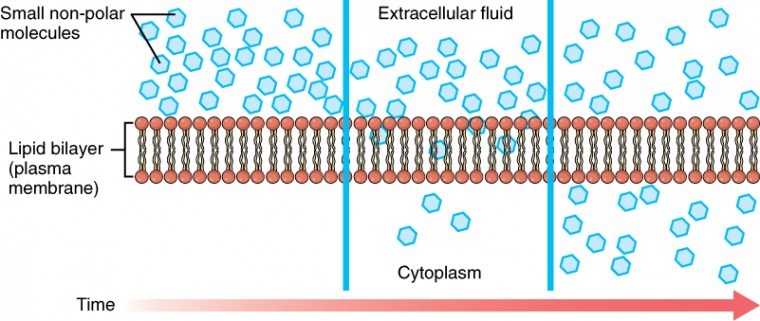
figur 3.15. Enkel Diffusion över cellmembranet (Plasma) strukturen hos lipid-dubbelskiktet tillåter endast små, icke-polära ämnen som syre och koldioxid att passera genom cellmembranet, ner i koncentrationsgradienten, genom enkel diffusion.
osmos är diffusion av vatten genom ett semipermeabelt membran (figur 3.16). Vatten kan röra sig fritt över cellmembranet i alla celler, antingen genom proteinkanaler eller genom att glida mellan lipidsvansarna i själva membranet. Det är emellertid koncentrationen av lösta ämnen i vattnet som bestämmer huruvida vatten kommer att röra sig in i cellen, ut ur cellen eller båda.

figur 3.16. Osmos osmos är diffusion av vatten genom ett semipermeabelt membran ner i koncentrationsgradienten. Om ett membran är permeabelt för vatten, men inte för ett löst ämne, kommer vatten att utjämna sin egen koncentration genom att diffundera till sidan av lägre vattenkoncentration (och därmed sidan av högre lösningskoncentration). I bägaren till vänster är lösningen på höger sida av membranet hypertonisk.
lösta ämnen i en lösning skapar osmotiskt tryck, ett tryck som drar vatten. Osmos uppstår när det finns en obalans av lösta ämnen utanför en cell kontra inuti cellen. Ju mer löst en lösning innehåller, desto större är det osmotiska trycket som lösningen kommer att ha. En lösning som har en högre koncentration av lösta ämnen än en annan lösning sägs vara hypertonisk. Vattenmolekyler tenderar att diffundera i en hypertonisk lösning eftersom det högre osmotiska trycket drar vatten (figur 3.17). Om en cell placeras i en hypertonisk lösning kommer cellerna att krympa eller krenera när vatten lämnar cellen via osmos. Däremot sägs en lösning som har en lägre koncentration av lösta ämnen än en annan lösning vara hypotonisk. Celler i en hypotonisk lösning tar på sig för mycket vatten och sväller, med risk för att så småningom spricker, en process som kallas Lys. En kritisk aspekt av homeostas i levande saker är att skapa en inre miljö där alla kroppens celler är i en isotonisk lösning, en miljö där två lösningar har samma koncentration av lösta ämnen (lika osmotiskt tryck). När celler och deras extracellulära miljöer är isotoniska är koncentrationen av vattenmolekyler densamma utanför och inuti cellerna, så vatten strömmar både in och ut och cellerna behåller sin normala form (och funktion). Olika organsystem, särskilt njurarna, arbetar för att upprätthålla denna homeostas.

figur 3.17. Koncentration av lösningar en hypertonisk lösning har en lösningskoncentration högre än en annan lösning. En isotonisk lösning har en lösningskoncentration lika med en annan lösning. En hypotonisk lösning har en lösningskoncentration lägre än en annan lösning.