Un indicateur chimique est utilisé pour ralentir la réaction chimique en changeant sa couleur jusqu’à ce que la réaction soit  soit terminée ou ait atteint son point d’équilibre. . Les indicateurs sont des molécules complexes qui sont elles-mêmes des acides faibles (par exemple la phénolphtaléine) ou des bases faibles (par exemple l’orange méthylique).il existe six principaux types d’indicateurs en chimie. ce sont les composés organiques.
soit terminée ou ait atteint son point d’équilibre. . Les indicateurs sont des molécules complexes qui sont elles-mêmes des acides faibles (par exemple la phénolphtaléine) ou des bases faibles (par exemple l’orange méthylique).il existe six principaux types d’indicateurs en chimie. ce sont les composés organiques.
Ils ont des couleurs différentes dans les solutions acides et alcalines. diverses fonctions spécifiques sont remplies par l’utilisation de différents types d’indicateurs. Le tournesol est un indicateur courant. Il est rouge dans les solutions acides et bleu dans les solutions alcalines. qui sont les suivants:
- bleu de thymol
- bleu de bromothymol
- orange de méthyle
- phénolphtaléine
- tournesol
- vert de bromcrésol
Chaque indicateur a une couleur spécifique dans le milieu acide qui change à un pH spécifique en une autre couleur dans le milieu basique. Par exemple, la phénolphtaléine est incolore dans la solution fortement acide et rouge dans la solution fortement basique. Il change de couleur à un pH d’environ 9. Cela signifie que la phénolphtaléine est incolore dans une solution dont le pH est inférieur à 9. Si le pH est supérieur à 9, la phénolphtaléine est rouge.
- Types of Indicators
- Characteristics of a chemical indicator
- Choix de l’indicateur
- Utilisation et applications d’indicateurs et types d’indicateurs
- 20 Exemples d’indicateurs
- Explanation of Indicators Behavior (types of Indicators)
- Exemple
- Le comportement de l’indicateur (Orange méthylique)
- En Milieu De Base
- Liste des indicateurs chimiques importants
- Mesure du pH d’une Solution (types d’indicateurs)
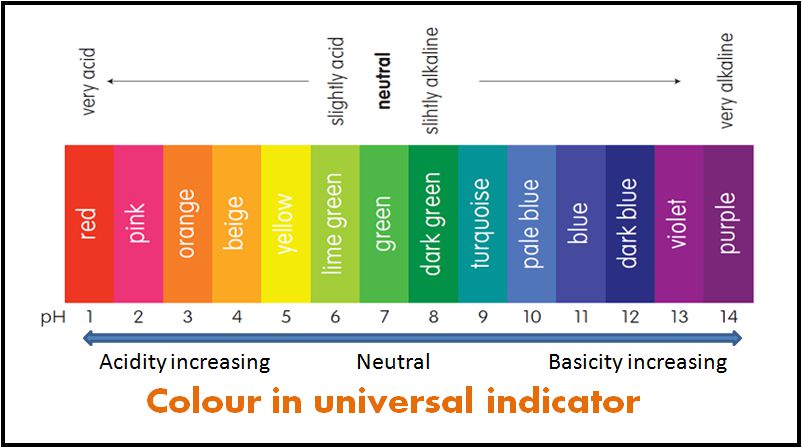
- Indicateur Universel
- Le pH-Mètre
Types of Indicators
- Acid-Base Indicator
- Natural acid-base indicators
- Indicators of oxidation-reduction reactions (redox)
- Adsorption (precipitation) indicators
- Metallochromic or complexometric indicators
- Chemical indicators with luminescence capacity
- Chemical moisture indicators
- Chemical indicators of sterilization
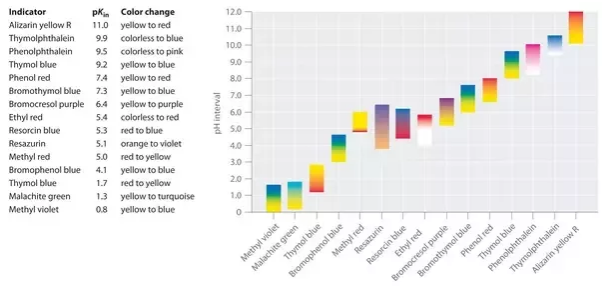
Characteristics of a chemical indicator
while you choose an indicator, il aurait dû répondre à certaines caractéristiques et à une série d’exigences pour une utilisation appropriée. les exigences sont les suivantes:
- il ne doit pas réagir avec des substances et doit être pur chimiquement.
- ne doit pas se dégrader dans l’ensemble de la réaction et doit rester chimiquement inerte.
- lorsque la réaction atteint le point d’équilibre ou se termine, l’indicateur doit avoir une coloration notable.
- le degré d’intégrité physique ne peut pas changer en le rendant plus épais.

Choix de l’indicateur
Pour les acides forts et les bases faibles, l’orange méthylique est utilisé. Pour une base forte et un acide faible, la phénolphtaléine est généralement choisie.
Utilisation et applications d’indicateurs et types d’indicateurs
Les indicateurs sont couramment utilisés pour déterminer le paramètre du titrage acido-basique.
| Indicateurs | Couleur Acide | Couleur Base | Couleur Neutre |
| Litmus | Rouge | Bleu | Violet |
| Orange méthylique | Rouge | Jaune | Orange |
| Phénolphtaléine | Incolore | Rose | Incolore |
| Indicateur universel | rouge | violet | Vert |
20 Exemples d’indicateurs
- Methyl Violet
- Azolythmine
- Leucomalachite green
- Methyl red
- Thymol Blue
- Bromocresol Green
- Methyl Yellow
- Methyl orange
- Bromophenol Blue
- Congo Red
- Bromocresol Purple
- Eriochrome Black
- Bromothymol Blue
- Alizarin Yellow
- Phenol Red
- Thymolphthalein
- Neutral Red
- Phenolphthalein
- Naphtholphthalein
- Cresol Red
Explanation of Indicators Behavior (types of Indicators)
L’indicateur se dissocie dans une solution et donne un ion de couleur différente de la molécule non dissociée de l’indicateur.
Exemple
Prenons l’exemple de l’orange méthylique, qui est de couleur rouge sous forme syndiquée et de couleur jaune sous forme syndiquée.
Si nous représentons un indicateur par la formule générale ‘HIn’ alors la dissociation de l’indicateur peut être montrée comme suit:
HIn ====== H ++In –
Le comportement de l’indicateur (Orange méthylique)
- En milieu acide
Si un acide est ajouté qui augmente la concentration de H + alors l’équilibre se déplacera vers la gauche et le « HIn » syndiqué prédominera et la solution sera rouge.
-
En Milieu De Base
Si une base est ajoutée qui réduit la concentration H + alors l’équilibre se déplacera vers la droite et le « In » ionisé prédominera et la solution sera jaune.
Liste des indicateurs chimiques importants
Noir ériochrome: Il s’agit d’un indicateur de poudre noir bleuâtre et complexométrique utilisé pour les titrages complexométriques et ajouté à l’aliquote pour obtenir la couleur pourpre foncé de la solution. l’utilisation la plus courante de cet indicateur est de déterminer la dureté de l’eau ou la détermination complexométrique de la dureté de l’eau. il se compose de carbonate de calcium CaCO3. lorsque tout le calcium est dissous dans le titrage de l’eau, l’indicateur affiche une couleur bleu électrique.
Orange de méthyle (MO): c’est l’indicateur de PH ou les colorants azoïques les plus importants et les plus courants pour la volumétrie acide-base qui est souvent utilisé avec l’acide pour déterminer la base en aliquote. c’est un indicateur de titrage fréquemment utilisé dans diverses industries telles que le papier, l’impression, l’industrie textile, etc. une grande quantité est gaspillée et rejetée dans les déchets d’eau industriels. à un PH élevé, il présente une coloration orange.
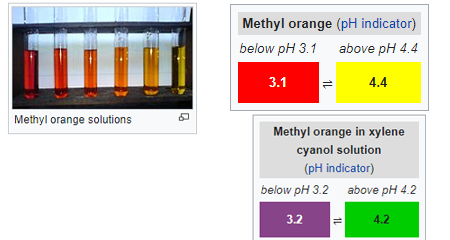
en modifiant les valeurs de PH, il montre également une variance de couleur distincte. bien que l’orange méthylique soit également un indicateur universel, il ne montre pas le spectre complet de la gamme de couleurs et a un point final très net.malgré son utilisation excessive, il possède certaines propriétés mutagènes, il faut donc éviter tout contact direct avec une substance dangereuse.
Violet de méthyle: le violet de méthyle est une famille (également connue sous le nom de violet de gentiane) d’indicateurs acido-basiques appartenant à des composés organiques et largement utilisés pour les colorants. il se transforme en une couleur jaune à une faible valeur de PH du violet de méthyle. la valeur du PH varie de 0,0 à 2,0 pour une couleur bleu-violet. pour les groupes méthyle attachés à cet indicateur, nous pouvons facilement modifier la couleur du colorant.
les différentes couleurs du violet de méthyle sont utilisées à des fins différentes, par exemple, le violet pour les textiles et le violet profond pour l’encre et la peinture. le gel de silice comprend également un indicateur d’hydratation. il est également utile à des fins médicales.
Phénolphtaléine: un autre indicateur important de volumétrie Acide-Base de formule C20H14O4. c’est un composé chimique qui appartient à la famille des phtaléines et peut également être écrit « Hin » ou « PHPH » en notation courte. il est utilisé comme réactif de laboratoire et est un indicateur incolore ayant une plage de PH de 8,5 qui montre du rose au rouge foncé he en augmentant le PH au-dessus de 9,0. être titré, utilisé pour déterminer l’acide en aliquote.
Bleu de thymol: le bleu de thymol est un indicateur acide-base également connu sous le nom de thymolsulfonéphtaléine et utilisé pour l’indicateur de PH. c’est une poudre cristalline de couleur brun rougeâtre ou vert brunâtre avec deux vires ou transitions (PH acide et PH Basique). en changeant la valeur du PH de 1,2 à 2,8, il devient jaune lors de la première transition. pendant la deuxième transition, la valeur du PH varie de 8,0 à 9,6, ce qui le transforme en bleu.
le bleu de thymol est considéré comme un indicateur universel qui possède également des propriétés toxiques pouvant provoquer des irritations. par conséquent, il est nécessaire de l’utiliser en toute sécurité. il est également très dangereux s’il est enflé, malheureusement. cela peut également entraîner des conséquences dangereuses lors de l’utilisation de la valeur de 10% ci-dessus.
Bleu de bromophénol: le bleu de bromophénol est également connu sous le nom de (tétrabromophénolphtaléine) et est utilisé comme indicateur de PH commun. à faible PH, montre une couleur jaune tandis qu’à PH 3,0 à 4,6 apparaissent comme violets.
Rouge du Congo: Le rouge du Congo est un composé organique connu comme un indicateur acide-Base commun qui se transforme en couleur bleu-violet des solutions à faible valeur de PH. il se transforme en rouge à un PH de 3,8 à 5,0, également connu sous le nom de colorant azoïque. sa formule moléculaire est C32H22N6Na2O6S2 ayant un poids moléculaire de 696,7 g / mol. Congo Red a été découvert par Paul Bottinger en 1883 en Allemagne. Le rouge Congo est également connu pour être soluble dans l’eau en solution colloïdale.
Rouge de méthyle: le rouge de méthyle est un indicateur acide-base de formule chimique C15H15N3O2 et de masse molaire 269,304 g / mol. il est également appelé Rouge acide C.I 2 qui montre une couleur rouge à faible valeur de PH et devient jaune à un PH de 4,4 à 6,2. c’est une poudre cristalline rouge foncé et également connue sous le nom de colorant azoïque.
Vert de bromocrésol: Le vert de bromocrésol ou BCG est un colorant triphénylméthane et est considéré comme un indicateur acido-basique qui montre une couleur jaune à faible PH. il se transforme également en une couleur bleu-vert en changeant la valeur du PH entre 3,8 et 5,4. il est largement utilisé à des fins de titrage, de croissance microbiologique et de gel d’agarose d’ADN, d’électrophorèse. le BCG a la formule chimique C21H14Br4O5 et le poids moléculaire 698g/mol. il est très soluble dans le benzène et l’eau.
Mesure du pH d’une Solution (types d’indicateurs)
-
Indicateur Universel
Certains indicateurs sont utilisés comme mélanges de types d’indicateurs. Les indicateurs de mélange donnent différentes couleurs à différentes valeurs de pH. Par conséquent, il est utilisé pour mesurer le pH d’une solution. Un tel indicateur mixte est appelé indicateur universel ou simplement indicateur de pH.
Le pH d’une solution peut être mesuré en plongeant un morceau de papier indicateur universel dans la solution. Le pH est ensuite trouvé en comparant la couleur obtenue avec un nuancier.
-
Le pH-Mètre
Le pH d’une solution peut être mesuré avec un pH-mètre. Il se compose d’une électrode de pH connectée à un compteur. L’électrode est plongée dans la solution et le compteur affiche le pH soit sur une échelle, soit numériquement. C’est une méthode de mesure du pH beaucoup plus fiable et précise que le papier indicateur universel, grâce à ce dernier souvent plus pratique.
Vous Pourriez Aussi Aimer:
- Fonction du tube à essai & Utilisations
- Vitesse de réaction
- Appareil de laboratoire et ses utilisations