Ein chemischer Indikator wird verwendet, um die chemische Reaktion zu verlangsamen, indem seine Farbe geändert wird, bis die Reaktion entweder  beendet oder erreicht seinen Gleichgewichtspunkt. . Indikatoren sind komplexe Moleküle, die selbst schwache Säuren (z.B. Phenolphthalein) oder schwache Basen (z.B. Methylorange) sind.es gibt sechs Haupttypen von Indikatoren in der Chemie. sie sind die organischen Verbindungen.
beendet oder erreicht seinen Gleichgewichtspunkt. . Indikatoren sind komplexe Moleküle, die selbst schwache Säuren (z.B. Phenolphthalein) oder schwache Basen (z.B. Methylorange) sind.es gibt sechs Haupttypen von Indikatoren in der Chemie. sie sind die organischen Verbindungen.
Sie haben unterschiedliche Farben in sauren und alkalischen Lösungen. verschiedene spezifische Funktionen werden durch die Verwendung verschiedener Arten von Indikatoren erfüllt. Lackmus ist ein gängiger Indikator. Es ist rot in den sauren Lösungen und blau in den alkalischen Lösungen. welche sind wie folgt:
- thymolblau
- Bromthymolblau
- Methylorange
- Phenolphthalein
- Lackmus
- Bromkresolgrün
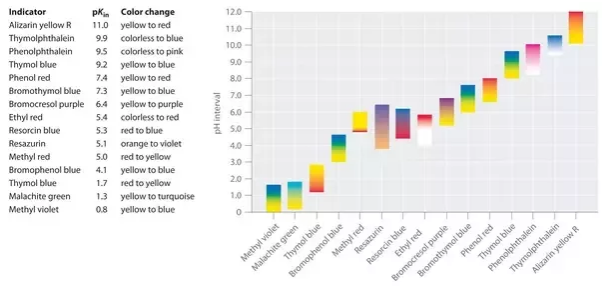
Jeder Indikator hat eine bestimmte Farbe im sauren Medium, die sich bei einem bestimmten pH-Wert in eine andere Farbe im basischen Medium ändert. Beispielsweise ist Phenolphthalein in der stark sauren Lösung farblos und in der stark basischen Lösung rot. Es ändert seine Farbe bei einem pH-Wert von etwa 9. Dies bedeutet, dass Phenolphthalein in einer Lösung mit einem pH-Wert von weniger als 9 farblos ist. Wenn der pH-Wert über 9 liegt, ist Phenolphthalein rot.
- Types of Indicators
- Characteristics of a chemical indicator
- Wahl des Indikators
- Verwendung und Anwendungen von Indikatoren und Arten von Indikatoren
- 20 Beispiele für Indikatoren
- Explanation of Indicators Behavior (types of Indicators)
- Beispiel
- Das Verhalten des Indikators (Methylorange)
- Im Basismedium
- Liste wichtiger chemischer Indikatoren
- Messung des pH-Wertes einer Lösung (Arten von Indikatoren)
- Universalanzeige
- Das pH-Meter
Types of Indicators
- Acid-Base Indicator
- Natural acid-base indicators
- Indicators of oxidation-reduction reactions (redox)
- Adsorption (precipitation) indicators
- Metallochromic or complexometric indicators
- Chemical indicators with luminescence capacity
- Chemical moisture indicators
- Chemical indicators of sterilization
Characteristics of a chemical indicator
while you choose an indicator, es sollte einige Eigenschaften und eine Reihe von Anforderungen für eine angemessene Verwendung erfüllt haben. die Anforderungen sind wie folgt:
- es darf nicht mit Substanzen reagieren und sollte rein chemisch sein.
- darf während der gesamten Reaktion nicht abgebaut werden und sollte chemisch inert bleiben.
- Wenn die Reaktion den Gleichgewichtspunkt erreicht oder endet, muss der Indikator eine merkliche Färbung aufweisen.
- Der Grad der körperlichen Unversehrtheit darf sich nicht ändern, indem er dicker wird.

Wahl des Indikators
Für starke Säure und schwache Base wird Methylorange verwendet. Für eine starke Base und schwache Säure wird üblicherweise Phenolphthalein gewählt.
Verwendung und Anwendungen von Indikatoren und Arten von Indikatoren
Indikatoren werden häufig verwendet, um den Endpunkt der Säure-Base-Titration herauszufinden.
| Indikatoren | Farbe in Säure | Farbe in Base | Farbe im neutralen Zustand |
| Lackmus | Rot | Blau | Lila |
| Methylorange | Rot | Gelb | Orange |
| Phenolphthalein | Farblos | Rosa | Farblos |
| Universalanzeige | rot | lila | Grün |
20 Beispiele für Indikatoren
- Methyl Violet
- Azolythmine
- Leucomalachite green
- Methyl red
- Thymol Blue
- Bromocresol Green
- Methyl Yellow
- Methyl orange
- Bromophenol Blue
- Congo Red
- Bromocresol Purple
- Eriochrome Black
- Bromothymol Blue
- Alizarin Yellow
- Phenol Red
- Thymolphthalein
- Neutral Red
- Phenolphthalein
- Naphtholphthalein
- Cresol Red
Explanation of Indicators Behavior (types of Indicators)
Der Indikator dissoziiert in einer Lösung und ergibt ein Ion, das eine andere Farbe hat als das nicht dissoziierte Molekül des Indikators.
Beispiel
Betrachten Sie das Beispiel der Methylorange, die in unionisierter Form rot und in unionisierter Form gelb gefärbt ist.
Wenn wir einen Indikator mit der allgemeinen Formel ‚HIn‘ darstellen, kann die Dissoziation des Indikators wie folgt dargestellt werden:
HIn ====== H+ + In-
Das Verhalten des Indikators (Methylorange)
- In saurem Medium
Wenn eine Säure hinzugefügt wird, die die Konzentration des H+ erhöht, bewegt sich das Gleichgewicht nach links und das unionisierte ‚HIn‘ überwiegt und die Lösung wird rot.
-
Im Basismedium
Wenn eine Base hinzugefügt wird, die die Konzentration reduziert H+ Dann bewegt sich das Gleichgewicht nach rechts und ionisiertes ‚In‘ überwiegt und die Lösung wird gelb.
Liste wichtiger chemischer Indikatoren
Eriochromschwarz: Es ist ein bläulich-schwarzer und komplexometrischer Pulveranzeiger, der für komplexometrische Titrationen verwendet und aliquot hinzugefügt wird, um die dunkelviolette Farbe der Lösung zu erhalten. die häufigste Verwendung dieses Indikators ist die Bestimmung der Wasserhärte oder die komplexometrische Bestimmung der Wasserhärte. es besteht aus Calciumcarbonat CaCO3. wenn das gesamte Kalzium in der Wassertitration gelöst ist, zeigt der Indikator eine elektrische blaue Farbe an.
Methylorange (MO): es ist der wichtigste und sehr gebräuchliche Azofarbstoff oder PH-Indikator für die Säure-Base-Volumetrie, der häufig mit Säure zur Bestimmung der Base in Aliquoten verwendet wird. es ist ein häufig verwendeter Titrationsindikator in verschiedenen Branchen wie Papier, Druck, Textilindustrie usw. eine große Menge wird verschwendet und in Brauchwasserabfälle eingeleitet. bei einem hohen PH-Wert zeigt es eine orangefarbene Färbung.
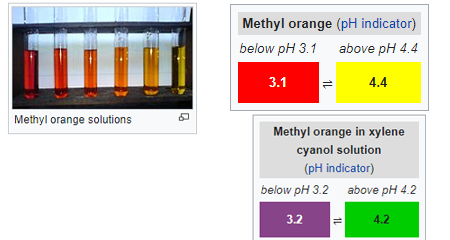
durch ändern der ph-werte, es zeigt auch deutliche farbe varianz. obwohl die Methylorange auch als universeller Indikator bekannt ist, zeigt sie nicht das gesamte Spektrum der Farbpalette und hat einen sehr scharfen Endpunkt.trotz des übermäßigen Gebrauchs hat es einige mutagene Eigenschaften, daher sollte man den direkten Kontakt aufgrund gefährlicher Substanzen vermeiden.
Methylviolett: Methylviolett ist eine Familie (auch als Enzianviolett bekannt) von Säure-Base-Indikatoren, die zu organischen Verbindungen gehören und in großem Umfang für Farbstoffe verwendet werden. bei einem niedrigen pH-Wert von Methylviolett verfärbt es sich gelb. der PH-Wert variiert von 0,0 bis 2,0 für eine blau-violette Farbe. für Methylgruppen, die an diesen Indikator gebunden sind, können wir die Farbe des Farbstoffs leicht ändern.
Die verschiedenen Farben von Methylviolett werden für verschiedene Zwecke verwendet, z. B. Lila für Textilien und Tiefviolett für Tinte und Farbe. Kieselgel enthält auch einen Feuchtigkeitsindikator. es ist auch für medizinische Zwecke nützlich.
Phenolphthalein: ein weiterer wichtiger Säure-Basen-Volumetrieindikator mit der Formel C20H14O4. es ist eine chemische Verbindung, die zur Phthalein-Familie gehört und als Kurznotation auch als „Hin“ oder „PHPH“ geschrieben werden kann. es wird als Laborreagenz verwendet und ist ein farbloser Indikator mit einem pH-Bereich von 8,5, der durch Erhöhung des PH-Werts über 9,0 rosa bis dunkelrote Farbe zeigt. titriert, zur Bestimmung von Säure in Aliquoten verwendet.
Thymolblau: Thymolblau ist ein Säure-Base-Indikator, der auch als Thymolsulfonephthalein bekannt ist und als PH-Indikator verwendet wird. es ist ein kristallines Pulver mit einer rotbraunen oder bräunlich-grünen Farbe mit zwei Vires oder Übergängen (saurer PH-Wert und basischer PH-Wert). durch Ändern des PH-Wertes von 1,2 auf 2,8 wird es im ersten Übergang gelb. während des zweiten Übergangs variiert der PH-Wert von 8,0 bis 9,6, wodurch er blau wird.
Thymolblau gilt als universeller Indikator, der auch einige toxische Eigenschaften aufweist, die zu Irritationen führen können. daher muss es sicher verwendet werden. es ist auch sehr gefährlich, wenn geschwollen, leider. es kann auch gefährliche Folgen haben, wenn der Wert über 10% verwendet wird.
Bromphenolblau: Bromphenolblau ist auch als (Tetrabromphenolphthalein) bekannt und wird als üblicher PH-Indikator verwendet. bei niedrigem PH-Wert, zeigt gelbe Farbe, während bei PH 3,0 bis 4,6 erscheinen als lila.
Kongo Rot: Kongo Rot ist eine organische verbindung und bekannt als eine gemeinsame Säure-Base-indikator, die verwandelt sich in die blau-violette farbe von lösungen bei niedrigen PH-wert. es wird bei PH 3,8 bis 5,0 rot, was auch als Azofarbstoff bekannt ist. seine molekulare Formel ist C32H22N6Na2O6S2 mit 696,7 g / mol Molekulargewicht. Kongorot wurde 1883 von Paul Bottinger in Deutschland entdeckt. Kongo Rot ist auch bekannt für wasserlöslich in kolloidaler Lösung.
Methylrot: Methylrot ist ein Säure-Base-Indikator mit der chemischen Formel C15H15N3O2 und einer Molmasse von 269,304 g / mol. es wird auch C.I Acid Red 2 genannt, das bei niedrigem PH-Wert eine rote Farbe zeigt und bei PH 4,4 bis 6,2 gelb wird. es ist ein dunkelrotes kristallines Pulver und auch als Azofarbstoff bekannt.
Bromkresolgrün: Bromkresolgrün oder BCG ist ein Triphenylmethanfarbstoff und gilt als Säure-Base-Indikator, der bei niedrigem PH-Wert eine gelbe Farbe zeigt. es verwandelt sich auch in eine blaugrüne Farbe, wenn der PH-Wert zwischen 3,8 und 5,4 geändert wird. es ist weit verbreitet für Titrationszwecke, mikrobiologisches Wachstum und DNA-Agarosegel, Elektrophorese. das BCG hat chemische Formel C21H14Br4O5 und Molekulargewicht 698g/mol. es ist in Benzol und Wasser gut löslich.
Messung des pH-Wertes einer Lösung (Arten von Indikatoren)
-
Universalanzeige
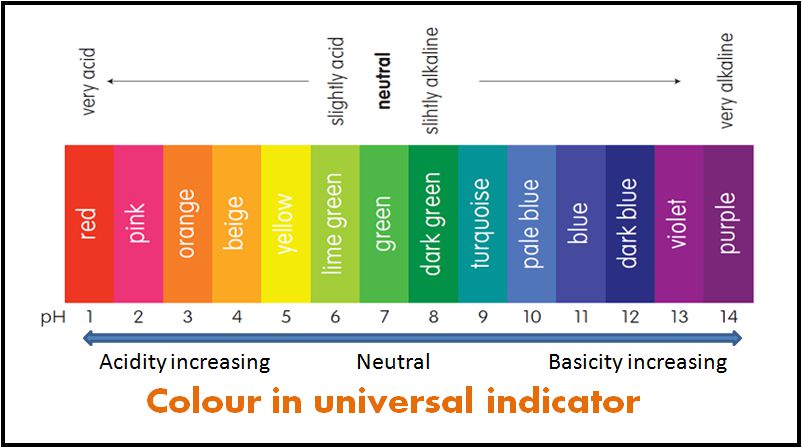
Einige Indikatoren werden als Mischungen aus Indikatortypen verwendet. Die Mischungsindikatoren ergeben unterschiedliche Farben bei unterschiedlichen pH-Werten. Daher wird es verwendet, um den pH-Wert einer Lösung zu messen. Ein solcher gemischter Indikator wird als Universalindikator oder einfach als pH-Indikator bezeichnet.
Der pH-Wert einer Lösung kann gemessen werden, indem ein Stück Universalindikatorpapier in die Lösung getaucht wird. Der pH-Wert wird dann durch Vergleichen der erhaltenen Farbe mit einer Farbkarte ermittelt.
-
Das pH-Meter
Der pH-Wert einer Lösung kann mit einem pH-Meter gemessen werden. Es besteht aus einer pH-Elektrode, die an ein Messgerät angeschlossen ist. Die Elektrode wird in die Lösung getaucht und das Messgerät zeigt den pH-Wert entweder auf einer Skala oder digital an. Es ist eine viel zuverlässigere und genauere Methode zur Messung des pH-Werts als das universelle Indikatorpapier, wodurch letzteres oft bequemer ist.
Sie können auch mögen:
- Reagenzglasfunktion & Verwendungen
- Reaktionsgeschwindigkeit
- Laborgeräte und ihre Verwendungen