molekyler eller ioner, der enten kan donere eller acceptere en proton, afhængigt af deres omstændigheder, kaldes amfiprotiske arter. Den vigtigste amfiprotiske art er selve vandet. Når en syre donerer en proton til vand, er vandmolekylet en protonacceptor og dermed en base. Omvendt, når en base reagerer med vand, donerer et vandmolekyle en proton og fungerer derfor som en syre.
en anden vigtig gruppe af amfiprotiske arter er aminosyrerne. Hvert aminosyremolekyle indeholder en sur carboksyl-gruppe og en basisk aminogruppe. Faktisk findes aminosyrerne normalt i form af “dobbelt ion” (tysk for “dobbelt ion”), hvor protonen er overført fra carboksyl til aminogruppen. I tilfælde af glycin er for eksempel
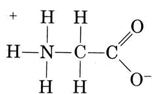
den kan donere en af protonerne fra N, ligesom en NH4+ ion kan donere en proton. På den anden side kan dens COO– ende acceptere en proton, ligesom en CH3COO– ion kan. Other common amphiprotic species are HCO3–, H2PO4–, HPO42–, and other anions derived from diprotic or triprotic acids.