et biologisk lægemiddel defineres i den europæiske lovgivning som ‘et lægemiddel, der indeholder et eller flere aktive stoffer fremstillet af eller afledt af en biologisk kilde.’1 i videste forstand omfatter biologiske lægemidler ethvert stof fremstillet i laboratoriet fra en levende organisme. Denne brede definition omfatter vacciner, immunterapier, biosimilære lægemidler, genterapi og stamcelle-eller vævsterapi. I denne artikel vil vi bruge udtrykket ‘biologiske lægemidler’ til at henvise til proteinbaserede lægemidler, såsom insulin.
biologiske eller naturlige kilder omfatter mikroorganismer, dyreceller eller humane celler. Nogle biologiske lægemidler efterligner proteiner, der er fremstillet naturligt i menneskekroppen. Eksempler inkluderer insulin, væksthormon og vækstfaktorer, der styrer produktionen af blodlegemer.
andre biologiske lægemidler er ikke kopier af proteiner, der forekommer naturligt i den menneskelige krop, men forbedres i laboratoriet for at forbedre biotilgængelighed, specificitet og effektivitet. De mest kendte eksempler på disse er antistoffer, der binder til overfladen af celler i kroppen og anvendes i vid udstrækning til behandling af kræft.
biologiske proteiner er meget større og mere komplekse molekyler end traditionelle kemiske lægemidler; det betyder, at de ikke kan fremstilles som en pille, så de skal administreres via en injektion.
Biologics er designet til at have meget specifikke effekter og til at interagere med specifikke mål i patientens krop, hovedsageligt på ydersiden af celler. En mere målrettet virkningsmekanisme bør føre til en større chance for, at lægemidlet har den ønskede virkning mod sygdommen, og bør resultere i færre bivirkninger end traditionelle lægemidler. En almindelig bivirkning ved biologiske lægemidler er imidlertid risikoen for immunreaktioner (immunogenicitet), hvorved patientens immunsystem genkender det biologiske som et ‘fremmed’ protein og forsøger at ødelægge det. Denne type immunreaktion kan stoppe den biologiske fra at virke helt eller kan bare forårsage irritation på injektionsstedet.
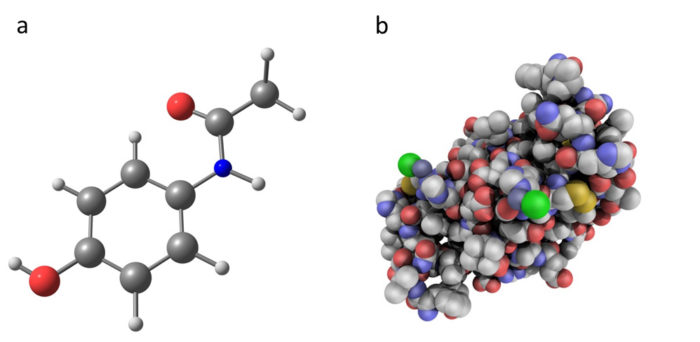 sammenligning af paracetamol (et kemisk molekyle) med insulin (en biologisk medicin). Paracetamol, som et kunstigt udviklet kemisk molekyle, har en meget enklere struktur end insulin, som er en proteinbaseret biologisk medicin. Biologiske lægemidler indeholder større og mere komplekse molekyler end traditionelle kemiske lægemidler.
sammenligning af paracetamol (et kemisk molekyle) med insulin (en biologisk medicin). Paracetamol, som et kunstigt udviklet kemisk molekyle, har en meget enklere struktur end insulin, som er en proteinbaseret biologisk medicin. Biologiske lægemidler indeholder større og mere komplekse molekyler end traditionelle kemiske lægemidler. yderligere ressourcer
- U. S. Food and Drug Administration (2014, 10. April). Hvad er et biologisk produkt? Hentet Juni 17, 2015, fra:
http://www.fda.gov/AboutFDA/Transparency/Basics/ucm194516.htm