- introduktion
- materialer og metoder
- patienter og prøver
- genetisk analyse
- statistisk analyse
- etisk Erklæring
- resultater
- kliniske egenskaber hos patienter med VHL-sygdom
- samlet overlevelse og CHB-specifik overlevelse hos patienter med VHL-sygdom
- Univariate og Multivariate regressionsanalyser for samlet overlevelse
- virkninger af forskellig Organinddragelse på CHB-specifik overlevelse
- effekten af RCC størrelse på patientens overlevelse
- Diskussion
- Datatilgængelighedserklæring
- Etikerklæring
- Forfatterbidrag
- finansiering
- interessekonflikt
- anerkendelser
- supplerende materiale
- forkortelser
introduktion
Von Hippel-Lindau (VHL) sygdom (MIM 193300) er et autosomalt dominerende tumorsyndrom forårsaget af kimlinjemutationer i tumorundertrykkende gen VHL placeret på 3p25. Forekomsten er ~1 ud af 36.000-40.000 levendefødte og har høj penetrans (1-3). Godartede og ondartede tumorer inklusive hemangioblastom i centralnervesystemet (CHB), retinal hemangioblastom (RA), nyrecellekarcinom (RCC), feokromocytom (PHEO), bugspytkirtellæsioner, inklusive cystisk læsion i bugspytkirtlen, og neuroendokrine tumorer i bugspytkirtlen (PCL/PNET), endolymfatisk sac-tumor (ELST) og papillære cystadenomer i epididymis eller bredt ledbånd er de vigtigste manifestationer af denne sygdom (4-11). Både intra-og interfamilial fænotypisk heterogenitet kan ses hos patienter med VHL-sygdom (12, 13).
mange undersøgelser viste, at overlevelsen af VHL-sygdomspatienter var værre end den generelle befolkning. En undersøgelse i 1990 viste, at medianoverlevelsen var 49 år (14). En nylig undersøgelse rapporterede, at den forventede forventede levetid for mandlige og kvindelige patienter var henholdsvis 67 og 60 år (15). I 2012 rapporterede en undersøgelse, at den gennemsnitlige forventede levetid for VHL-sygdomspatienter var 52 år (16). Tidligere rapporterede risikofaktorer for overlevelse af patienter med VHL-sygdom omfattede tidligt fødselsår, færre overvågningsbesøg, kvindelig køn, positiv familiehistorie, tidlig sygdomsdebut, trunkerende mutationstype og RCC større end 3 cm (15, 17, 18). Imidlertid har ingen tidligere forskning undersøgt virkningerne af involvering af hvert organ i en stor patientgruppe.
virkningen af involvering af forskellige organer på overlevelse er blevet undersøgt i andre systemiske sygdomme. For eksempel indikerer livmoderinddragelse dårligere overlevelse hos patienter med diffust stort B-celle lymfom end hos dem med involvering af andre organer (19). Yuda et al. rapporterede, at perikardieeffusion og involvering af flere organer var forudsigere for dødelighed hos patienter med systemisk let kæde amyloidose (20). Selvom nogle tidligere undersøgelser etablerede genotype-fænotype-korrelationer i VHL-sygdom: patienter med missense-mutationer er mere tilbøjelige til at udvikle feokromocytom, og patienter med trunkerende mutationer er mere tilbøjelige til at udvikle RCC og CHB (21-23). De eksisterende genotype-fænotype korrelationer kan ikke forklare andre komplekse fænotyper. Derfor er det vigtigt at studere prognosen for VHL-sygdom fra et organinddragelsesperspektiv (23, 24).
i denne undersøgelse havde vi til formål at studere den samlede overlevelse og CHB-specifik overlevelse i en stor VHL-sygdomspatientgruppe, der inkluderer asymptomatiske mutationsbærere og at undersøge indflydelsen af CHB, RCC, RA, PCL/PNET og PHEO for at forbedre genetisk rådgivning og kliniske behandlingsstrategier for VHL-sygdomspatienter.
materialer og metoder
patienter og prøver
vi rekrutterede alle patientoplysninger gemt i databasen over VHL-sygdomspatienter på Peking University First Hospital. Diagnosen blev etableret, da patienten viste sig at bære en kimlinie VHL-genmutation eller opfyldte de tidligere beskrevne kliniske kriterier (25, 26). Mindst en patient blev diagnosticeret ved VHL-mutationstest i hver familie, undtagen dem, der nægtede testen. I alt blev 376 patienter fra 134 familier diagnosticeret. Kliniske data inklusive køn, familiehistorie, mutationstype, begyndelsesalder for hvert organ og dødsårsagen blev opnået ved at gennemgå lægejournaler eller samtale familiemedlemmer. Fyrre patienter blev udelukket fra undersøgelsen på grund af uklare data. I alt 336 patienter fra 125 familier blev endelig tilmeldt denne kohorte, hvor 298 af patienterne havde mindst en VHL-sygdomsrelateret læsion, og 38 patienter var asymptomatiske mutationsbærere.
vi registrerede overlevelsesstatus for de 336 patienter fra fødsel til død eller til slutningen af opfølgningen i Juni 2017. Den mediane opfølgningstid var 37 år / person (interval 1-75 år) med i alt 12.966 personår.
genetisk analyse
et Chiaamp DNA-Blodminikit (CHIAGEN, Tyskland) blev brugt til at udtrække genomisk DNA fra perifert blod fra mistænkte patienter. Tre kodende eksoner og deres flankerende introniske regioner blev amplificeret ved PCR ved anvendelse af primere beskrevet tidligere (27). Missense-mutationer, splejsningsmutationer og små Indel ‘ er blev påvist ved direkte sekventering. Et multipleks ligeringsafhængigt probe-amplifikationssæt (MLPA, P016-C2, MRC-Holland, Amsterdam) blev brugt til at detektere store sletninger. Store ekson-sletninger blev bekræftet ved kvantitativ PCR i realtid med primerne beskrevet af Ebenaser et al. (28). Patienterne blev opdelt i en missense-mutationsgruppe (n = 162) og en trunkerende mutationsgruppe (n = 174) baseret på de tidligere beskrevne kriterier (18).
statistisk analyse
patientdemografi og grundlæggende kliniske data blev analyseret ved hjælp af beskrivende statistik. Begyndelsesalderen for læsioner i forskellige organer blev sammenlignet ved hjælp af Kruskal-Vægis-test; parvise sammenligninger blev udført, og P-værdien blev bestemt efter justering af Bonferroni. Begyndelsesalderen i CNS-gruppen og abdominalgruppen blev sammenlignet ved hjælp af Mann-Hvidney U-test.
da opfølgning blev udført fra fødslen, har patienter før sygdomsdebut og efter sygdomsdebut forskellige risici for overlevelse. Denne situation passer ikke til kravene i den forholdsmæssige faremodel, hvilket gør regressionsanalysen uhensigtsmæssig. I stedet blev inddragelsen af hvert organ behandlet som et tidsafhængigt kovariat i regressionsmodellen. Univariate og multivariate regressionsanalyser blev brugt til at vurdere virkningerne af CHB, RCC, RA, PCL/PNET og PHEO på den samlede overlevelse. Vi brugte derefter univariate og multivariate regressionsanalyser til at bestemme effekten af RCC, RA, PCL/PNET og PHEO på CHB-specifik overlevelse, fordi CHB er den mest almindelige dødsårsag hos patienter med VHL-sygdom.
statistisk analyse blev udført ved hjælp af SPSS 22.0 og GraphPad Prism (version 6). P < 0.05 blev betragtet som statistisk signifikant. For parvise sammenligninger blev Bonferronis justering udført.
etisk Erklæring
denne undersøgelse blev godkendt af det institutionelle Gennemgangsudvalg for Peking University First Hospital (Beijing, Kina), og skriftligt samtykke blev opnået fra alle patienter.
resultater
kliniske egenskaber hos patienter med VHL-sygdom
CHB var den mest almindelige læsion i vores undersøgelse, og mere end halvdelen af patienterne havde CHB-læsioner (62,2%). PCL / PNET var den næsthyppigste læsion (46,4%). Næsten to tredjedele af de afdøde patienter døde af CHB (66,2%). Prævalensen af CHB og RCC i denne undersøgelse var generelt i overensstemmelse med resultaterne fra tidligere undersøgelser (supplerende tabel 1). De mediane år var 30 år ved begyndelsen af CHB og RA og var >30 år ved begyndelsen af RCC, PHEO og PCL/PNET (tabel 1). Vi kombinerede CHB og RA i en CNS-gruppe og RCC, PHEO og PCL/PNET i en abdominal gruppe. Fordelingen af begyndelsesalderen i de to grupper er vist i Figur 1. Medianalderen ved begyndelsen af tumorer i abdominale og CNS-grupper var henholdsvis 34 og 29 år. Mann-Hvidney U-test viste, at begyndelsesalderen var signifikant yngre i CNS-gruppen end i abdominal gruppe (P < 0,001).
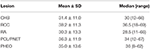
tabel 1. Alder ved begyndelsen af VHL-relaterede læsioner.
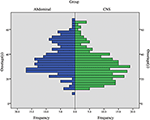
Figur 1. Begyndelsesalderfrekvensen i CNS-gruppen (inklusive CHB & RA-patienter) og abdominal gruppe (inklusive RCC, PHEO & PCL/PNET-patienter).
samlet overlevelse og CHB-specifik overlevelse hos patienter med VHL-sygdom
den samlede overlevelse og CHB-specifikke overlevelse er vist i figur 2a,B. median overlevelsestid for patienter med VHL-sygdom var 66 år. Tilsammen udgjorde CHB og RCC 95,6% af alle dødsfald. Næsten to tredjedele af patienterne døde af CHB-relaterede tilstande, og mere end en tredjedel af patienterne døde af RCC. Blandt 209 patienter med CHB døde 45 patienter af CHB, 10 patienter døde af RCC. Blandt 138 patienter med RCC døde 16 patienter af RCC, 4 patienter døde af CHB. Blandt 86 patienter med begge læsioner bidrog CHB og RCC ligeligt til afdøde patienter, begge forårsager 8 dødsfald. CHB var den mere almindelige dødsårsag end RCC i vores undersøgelse (tabel 2).
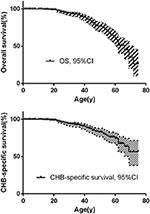
figur 2. (A) den samlede overlevelse af VHL-patienter. B) CHB-specifik overlevelse hos VHL-patienter.
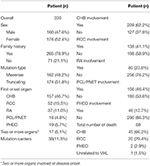
tabel 2. Baseline kliniske egenskaber hos patienter med VHL-sygdom.
Univariate og Multivariate regressionsanalyser for samlet overlevelse
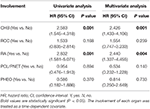
tabel 3. Univariate og multivariate regressionsanalyser for samlet overlevelse.
virkninger af forskellig Organinddragelse på CHB-specifik overlevelse
fordi CHB tegnede sig for næsten to tredjedele af dødsfaldet (66.2%, 45 af 68) og CHB var en signifikant risikofaktor for samlet overlevelse i både univariate og multivariate regressionsanalyser undersøgte vi yderligere effekten af anden organinddragelse på CHB-specifik overlevelse. Inddragelsen af hvert organ blev behandlet som et tidsafhængigt kovariat.
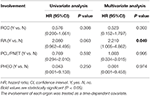
Tabel 4. Univariate og multivariate tidsafhængige regressionsanalyser af effekten af forskellige organinddragelse på CHB-specifik overlevelse.
effekten af RCC størrelse på patientens overlevelse
vores database indeholdt kun 51 patienter med en komplet naturhistorie af RCC. Vi kategoriserede yderligere disse patienter i 2 grupper: den første gruppe, RCC-diameter på <3 cm gennem deres naturlige historie (n = 15), og den anden gruppe, RCC-diameter på >3 cm i perioden med deres naturlige historie (n = 36). Alle patienter i den første gruppe overlevede, tre patienter i den anden gruppe døde ved afslutningen af opfølgningen; den ene døde af en CHB-relateret tilstand, og de to andre døde af metastatisk RCC med RCC-diameterne på 7 og 8,5 cm på diagnosetidspunktet.
Diskussion
i denne undersøgelse var CHB og RCC stadig de førende årsager til dødsfald hos VHL-patienter, sammen forårsagede 95,6% af alle dødsfald. Vi analyserede effekten af hvert involveret organ på den samlede overlevelse og CHB-specifik overlevelse af VHL-sygdomspatienter. CHB og RA var uafhængige risikofaktorer for samlet overlevelse. Overraskende nok var RCC ikke en signifikant risikofaktor for samlet overlevelse. RA var den eneste risikofaktor for CHB-specifik overlevelse. I de sidste årtier er dødsårsagen hos VHL-sygdomspatienter skiftet meget. I undersøgelser af VHL-sygdom, der blev offentliggjort i de tidlige år, bidrog CHB og RCC omtrent ligeligt til patienternes død; i nogle undersøgelser var antallet af dødsfald på grund af RCC endnu dobbelt så meget som på grund af CHB (29). I nylige undersøgelser var andelen af CHB-relateret død imidlertid signifikant højere end for RCC-relateret død (supplerende tabel 1). En sådan uoverensstemmelse kan delvist forklares ved udviklingen af avancerede billeddannelsesteknologier og behandlingsstrategier inklusive målrettet terapi, minimalt invasiv kirurgi og aktiv overvågning af RCC ‘er, bidrager til den tidlige diagnose og effektiv behandling før metastase af RCC’ er. På den anden side skal den farmakologiske og kirurgiske behandling af CHB forbedres yderligere.
selvom RCC ved VHL-sygdom normalt anses for at være mindre ondartet og mindre tilbøjelige til at metastasere og have højere kræftspecifik overlevelse sammenlignet med sporadisk klar celle RCC (30), er RCC stadig en vigtig dødsårsag hos VHL-patienter. De fleste dødsfald skyldes tumormetastase og tumorrelaterede komplikationer. Overraskende i denne undersøgelse var virkningen af RCC på den samlede overlevelse ikke signifikant. En koreansk undersøgelse med 24 VHL-sygdomspatienter offentliggjort i 2009 viste lignende resultater (31). Tidligere undersøgelser har vist, at RCC-diameteren på >3 cm er en risikofaktor for metastase og samlet overlevelse (17, 32). I VHL-sygdomspatientdatabasen analyserede vi i denne undersøgelse blandt de 51 patienter med fuldstændig naturlig historie med RCC-tumorstørrelse, kun 3 patienter døde under opfølgning, hvilket gør det umuligt at udføre overlevelsesanalyse. Jilg et al. rapporterede, at den gennemsnitlige tumordiameter hos patienter uden metastaser var signifikant mindre end hos patienter med metastaser (33). Duffey et al. rapporterede i 2004, at patienter med RCC ‘ er mindre end 3 cm havde en lav risiko for fjern metastase og anbefalede 3 cm som afskæringsværdi for kirurgisk indgreb (34). RCC er stadig en vigtig dødsårsag hos patienter med VHL-sygdom. Tumorstørrelse og vækstrate kan være af større betydning for prognosen. Større undersøgelser med længere opfølgningsperioder er nødvendige for at studere forholdet mellem overlevelse og RCC ‘ er.
selvom CHB anses for at være en godartet tumor, kan det forårsage alvorlige neurologiske defekter, såsom hydrocephalus, herniation og hjernestammekompression og i sjældne tilfælde intrakraniel blødning (14, 29). Perioperative / postoperative komplikationer kan også føre til død hos CHB-patienter. Hyppigheden af CHB-involvering i undersøgelsesprøven kan påvirke overlevelsesanalysen. 62,2% (209 ud af 336) patienter havde CHB i vores undersøgelse, hvilket er under det gennemsnitlige antal patienter med CHB i undersøgelserne anført i supplerende tabel 1. CHB tegnede sig for 66.2% af alle dødspatienter i denne kohorte, hvilket er højere end 6 af de 7 undersøgelser, der er anført i supplerende tabel 1. Dette kan skyldes fødslenår af patienter. I en dansk undersøgelse offentliggjort i 2016 stiger CHB-relateret dødelighed fra 42% (fødselsår 1901-1955, 18 af 50) til 83% (fødselsår 1956-2010, 5 af 6) med en samlet CHB-relateret dødelighed på 51%. Forfatteren tilskrev en sådan uoverensstemmelse med fremskridt i diagnose og behandling af RCC (15). I vores undersøgelse blev 83,3% (280 ud af 336) patienter født efter 1955, kun 16,7% (56 ud af 336)patienter blev født før 1955. Og CHB-relateret dødelighed var 60,1% for patienter født før 1955, men steg til 70,1 og 75% for patienter født i 1955-1975 og efter 1975. RA forårsager blindhed; men i vores undersøgelse var RA en signifikant risikofaktor for samlet overlevelse og CHB-specifik overlevelse. Nethinden embryologisk stammer fra hjernen, og både CHB og RA deler de samme histopatologiske strukturer (7). Onkogenesen af hæmangioblastom er relateret til dysregulering af HIF-vejen, hvilket fører til en stigning i vaskulær endotelvækstfaktor og erythropoietin (35, 36). Franke et al. rapporterede, at deletionsmutationer i VHL-genet havde en højere risiko for CHB og RA (37). Således antager vi, at RA kan afspejle en større byrde af CHB, hvilket fører til ugunstig overlevelse af VHL-sygdomspatienter.
Hemangioblastom er en signifikant risikofaktor for overlevelse. En anden mulig forklaring på dette er den tidligere begyndelsesalder for denne tumor. Vores tidligere forskning viste, at tidlig debut alder var en risikofaktor for samlet overlevelse og VHL sygdomsspecifik overlevelse (18). Medianalderen ved begyndelsen af CHB og RA var 28.Henholdsvis 5 og 30 år er den tidligste blandt alle VHL-relaterede læsioner. Når CHB og RA blev kombineret som en CNS-gruppe, havde denne gruppe også tidligere begyndelsesalder end abdominal gruppe. Vi gennemførte en Kruskal-Vægis test for at sammenligne læsionernes begyndelsesalder i 5 organer, og P < 0,001 antyder en signifikant forskel. Vi foretog yderligere parvise sammenligninger, og P-værdien blev vurderet efter Bonferroni-justering, og der blev fundet signifikante forskelle i aldersstart mellem RA-PCL/PNET, RA-RCC, CHB-PCL/PNET og CHB-RCC (supplerende tabel 2). Selvom hæmangioblastom anses for at være en godartet tumor, kan dets tidlige begyndelse forværre overlevelsen af VHL-sygdomspatienterne.
flere tidligere undersøgelser, der kun omfattede symptomatiske patienter, kan have partiske resultater, der overvurderer antallet af involverede organer og effekten af involverede organer på patientens overlevelse (31, 38). Vi brugte først den tidsafhængige regressionsanalyse til at evaluere effekten af hvert involveret organ på overlevelsen af VHL-sygdomspatienter. I en tidligere undersøgelse blev den samlede overlevelse beregnet fra sygdomsdiagnose til død; asymptomatiske mutationsbærere kan dog udvikle tumorer senere og passer ikke til kravene i den proportionale faremodel (17).
denne store retrospektive undersøgelse fokuserede på forskellige organinddragelse på overlevelse hos VHL-sygdomspatienter fra et klinisk perspektiv. Forventet levetid for VHL-sygdomspatienter var 66 år. Tilstedeværelsen af CHB og RA var de uafhængige risikofaktorer for samlet overlevelse. RCC var ikke en signifikant risikofaktor for samlet overlevelse. RA var en risikofaktor for CHB-specifik overlevelse. Patienter med RA bør have omhyggelig aktiv overvågning på grund af den højere risiko for død fra CHB. Fremtidige større studier med længere opfølgningsperioder er nødvendige for at undersøge effekten af RCC på overlevelse af VHL-patienter. Disse fund kan hjælpe med at guide fremtidig genetisk rådgivning og klinisk beslutningstagning.
Datatilgængelighedserklæring
datasættene genereret til denne undersøgelse er tilgængelige på anmodning til den tilsvarende forfatter
Etikerklæring
undersøgelserne, der involverede menneskelige deltagere, blev gennemgået og godkendt af institutionel Gennemgangsudvalg for Peking University First Hospital (Beijing, Kina). Skriftligt informeret samtykke til at deltage i denne undersøgelse blev leveret af deltagernes værge/pårørende.
Forfatterbidrag
KG og LC var ansvarlige for konceptet og designet af undersøgelsen. BS og JS behandlede de kliniske data. SL og SP udførte det statistiske arbejde. BH og JHO har skrevet manuskriptet. KM og JSJ giver tallene og tabellerne. Alle forfattere reviderede manuskriptet.
finansiering
dette arbejde blev støttet af de centrale universiteters grundlæggende forskningsfonde (grant BMU2018JI002).
interessekonflikt
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
forfatterne takker Li i den statistiske afdeling på Peking University First Hospital for hendes hjælp med de statistiske analyser og Bu ding-Fang, medicinsk Eksperimentcenter, Peking University First Hospital, for hans tekniske assistance.
supplerende materiale
forkortelser
CHB, hemangioblastom i centralnervesystemet; RA, retinal hemangioblastom; RCC, nyrecellekarcinom; PHEO, feokromocytom; PCL/PNET, cystisk læsion i bugspytkirtlen og neuroendokrine tumorer i bugspytkirtlen.
7. Maher ER, Moore på. Kliniske egenskaber ved okulær angiomatose i von Hippel-Lindau sygdom og korrelation med kimlinjemutation. Arch Ophthalmol. (1999) 117:371–8. doi: 10.1001 / archopht.117.3.371
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
10. Jeg vil gerne, Lonser RR, Glenn GM, Oldfield EH. Den naturlige historie af hæmangioblastomer i centralnervesystemet hos patienter med von Hippel-Lindau sygdom. J Neurosurg. (2003) 98:82–94. doi: 10.3171 / jns.2003.98.1.0082
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
13. Han er en af de mest populære i verden. En analyse af fænotypisk variation i det familiære kræftsyndrom von Hippel-Lindau sygdom: bevis for modifikationseffekter. Am J Hum Genet. (1998) 63:1025–35. doi: 10.1086/302037
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
19. El-Galaly TC, Cheah CY, Hutchings M, Mikhaeel NG, Savage KJ, Sehn LH, et al. Uterin, men ikke ovarie, Kvindelig reproduktionsorganinddragelse ved præsentation ved diffust stort B-celle lymfom er forbundet med dårlige resultater og en høj frekvens af sekundær CNS-involvering. Br J Hæmatol. (2016) 175:876–83. doi: 10.1111 / bjh.14325
CrossRef Fuld Tekst | Google Scholar
20. Yuda S, Hayashi T, Yasui K, Muranaka A, Ohnishi H, Hashimoto A, et al. Perikardieeffusion og involvering af flere organer er uafhængige forudsigere for dødelighed hos patienter med systemisk let kæde amyloidose. Praktikant Med. (2015) 54:1833–40. doi: 10.2169 / internalmedicin.54.3500
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
27. Ning, Li T, Bu D, et al. Familiehistorie af von Hippel-Lindau sygdom var usædvanlig hos kinesiske patienter: antyder den højere frekvens af de novo mutationer i VHL-genet hos disse patienter. J Hum Genet. (2012) 57:238–43. doi: 10.1038 / jhg.2012.10
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
30. Neumann HP, Bender BU, Berger DP, Laubenberger J, Schultse-Seemann m, Vådterauer U, et al. Prævalens, morfologi og biologi af nyrecellekarcinom i von Hippel-Lindau sygdom sammenlignet med sporadisk nyrecellekarcinom. J Urol. (1998) 160:1248–54. doi: 10.1016 / S0022-5347(01)62509-6
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
31. Ju HJ, Lee JS, Lee JS, Choi YD. Kliniske egenskaber ved nyrecellekarcinom hos koreanske patienter med von Hippel-Lindau-sygdom sammenlignet med sporadisk bilateralt eller multifokalt nyrecellekarcinom. J Koreansk Med Sci. (2009) 24:1145–9. doi: 10.3346 / jkms.2009.24.6.1145
CrossRef Fuld Tekst | Google Scholar
35. Torben Jørgensen, Jørgen Jørgensen, Jørgen Jørgensen, Jørgen Jørgensen. Opregulering af vaskulær endotelvækstfaktor og dens receptorer i von Hippel-Lindau sygdomsassocierede og sporadiske hæmangioblastomer. Kræft Res. (1995) 55:1358-64.
PubMed Abstrakt / Google Scholar
36. Krieg M, Marti HH, plade KH. Coekspression af erythropoietin og vaskulær endotelvækstfaktor i nervesystemtumorer forbundet med von Hippel-Lindau tumor suppressor gen tab af funktion. Blod. (1998) 92:3388–93.
PubMed Abstrakt / Google Scholar
37. Franke G, Bausch B, Hoffmann MM, Cybulla M, Vilhelm C, Kohlhase J, et al. Alu-Alu-rekombination ligger til grund for langt størstedelen af store VHL-kimlinie-sletninger: molekylær karakterisering og genotype-fænotype-korrelationer hos VHL-patienter. Hum Mutat. (2009) 30:776–86. doi: 10.1002 / humu.20948
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar