Moleküle oder Ionen, die je nach ihren Umständen ein Proton spenden oder aufnehmen können, werden als amphiprotische Spezies bezeichnet. Die wichtigste amphiprotische Art ist das Wasser selbst. Wenn eine Säure ein Proton an Wasser abgibt, ist das Wassermolekül ein Protonenakzeptor und damit eine Base. Umgekehrt, wenn eine Base mit Wasser reagiert, spendet ein Wassermolekül ein Proton und wirkt daher als Säure.
Eine weitere wichtige Gruppe amphiprotischer Spezies sind die Aminosäuren. Jedes Aminosäuremolekül enthält eine saure Carboxylgruppe und eine basische Aminogruppe. Tatsächlich existieren die Aminosäuren normalerweise in Zwitterion (deutsch für „Doppelion“) Form, wo das Proton von der Carboxylgruppe zur Aminogruppe übergegangen ist. Im Falle von Glycin ist das Zwitterion beispielsweise
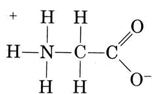
Das Zwitterion kann eines der Protonen aus dem N spenden, genau wie ein NH4 + -Ion ein Proton spenden kann. Auf der anderen Seite kann sein COO–Ende ein Proton aufnehmen, genau wie ein CH3COO– Ion. Other common amphiprotic species are HCO3–, H2PO4–, HPO42–, and other anions derived from diprotic or triprotic acids.