Indium ist ein glänzendes silbriges Metall, das so weich und formbar ist, dass es mit einem Fingernagel zerkratzt und in nahezu jede Form gebogen werden kann. In der Natur ist Indium recht selten und kommt fast immer als Spurenelement in anderen Mineralien vor — insbesondere in Zink und Blei —, aus denen es typischerweise als Nebenprodukt gewonnen wird. Seine geschätzte Häufigkeit in der Erdkruste beträgt 0,1 Teile pro Million (ppm) – laut der Royal Society of Chemistry etwas häufiger als Silber oder Quecksilber.
Indium hat einen niedrigen Schmelzpunkt für ein Metall: 313.9 grad Fahrenheit (156,6 grad Celsius). Bei etwas über dieser Temperatur brennt es mit einer violetten oder indigofarbenen Flamme. Der Name Indium leitet sich von dem brillanten Indigolicht ab, das es in einem Spektroskop zeigt.
Nur die Fakten
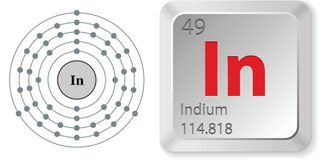
- Ordnungszahl (Anzahl der Protonen im Kern): 49
- Atomsymbol (im Periodensystem der Elemente): In
- Atomgewicht (durchschnittliche Masse des Atoms): 114.8.8
- Dichte: 7,31 Gramm pro Kubikzentimeter
- Phase bei Raumtemperatur: Fest
- Schmelzpunkt: 313,88 Grad Fahrenheit (156.6 grad C)
- Siedepunkt: 3.761,6 F (2.072 C)
- Anzahl der Isotope (Atome desselben Elements mit einer anderen Anzahl von Neutronen): 35 deren Halbwertszeiten bekannt sind; 1 stabil; 2 natürlich vorkommend
- Am häufigsten vorkommendes Isotop: In-115
Entdeckung
Indium wurde 1863 von dem deutschen Chemiker Ferdinand Reich an der Freiberger Bergschule in Deutschland entdeckt. Reich untersuchte eine Probe einer Zinkmineralmischung, von der er glaubte, dass sie das kürzlich entdeckte Element Thallium enthalten könnte. Nachdem er das Erz geröstet hatte, um den größten Teil des Schwefels zu entfernen, trug er Salzsäure auf die verbleibenden Materialien auf. Er beobachtete dann einen gelblichen Feststoff erscheinen. Er vermutete, dass dies das Sulfid eines neuen Elements sein könnte, aber da er farbenblind war, bat er den deutschen Chemiker Hieronymus T. Richter, das Spektrum der Probe zu untersuchen. Richter bemerkte eine brillante violette Linie, die nicht mit der Spektrallinie eines bekannten Elements übereinstimmte.
Gemeinsam isolierten die beiden Wissenschaftler eine Probe des neuen Elements und gaben seine Entdeckung bekannt. Sie nannten das neue Element Indium, nach dem lateinischen Wort indicum, was Violett bedeutet. Leider wurde ihre Beziehung sauer, als Reich erfuhr, dass Richter laut der Royal Society of Chemistry (RSC) behauptet hatte, der Entdecker zu sein.
Verwendet
Mehr als ein Jahrhundert nach der Entdeckung von Indium lag das Element immer noch in relativer Dunkelheit, da niemand wusste, was damit zu tun war. Heute ist Indium in Form von Indiumzinnoxid (ITO) für die Weltwirtschaft von entscheidender Bedeutung. Dies liegt daran, dass ITO nach wie vor das beste Material ist, um den wachsenden Bedarf an LCDs (Flüssigkristallanzeigen) in Touchscreens, Flachbildfernsehern und Sonnenkollektoren zu decken.
ITO hat mehrere Eigenschaften, die es perfekt für LCDs und andere Flachbildschirme machen: Es ist transparent; leitet Strom; haftet stark auf Glas; widersteht Korrosion; und ist chemisch und mechanisch stabil.
ITO wird auch häufig zur Herstellung dünner Beschichtungen für Glas und Spiegel verwendet. Wenn ITO beispielsweise über die Windschutzscheiben von Flugzeugen oder Autos beschichtet wird, kann das Glas enteisen oder entnebeln und die Anforderungen an die Klimaanlage reduzieren.
Die wachsende Nachfrage nach LCDs hat laut RSC die Preise für Indium in den letzten Jahren erheblich in die Höhe getrieben. Recycling und Produktionseffizienz haben jedoch dazu beigetragen, ein gutes Gleichgewicht zwischen Angebot und Nachfrage zu schaffen.
Indium wird häufig zur Herstellung von Legierungen verwendet und wird oft als „Metallvitamin“ bezeichnet, was bedeutet, dass winzige Mengen an Indium laut RSC einen drastischen Unterschied in einer Legierung ausmachen können. Zum Beispiel macht das Hinzufügen kleiner Mengen Indium zu Gold- und Platinlegierungen sie viel härter. Indiumlegierungen werden verwendet, um die Lager von Hochgeschwindigkeitsmotoren und anderen Metalloberflächen zu beschichten. Seine niedrigschmelzenden Legierungen werden auch in Sprinklerköpfen, Brandschutztürverbindungen und Schmelzstopfen verwendet.
Indiummetall bleibt bei sehr niedrigen Temperaturen ungewöhnlich weich und formbar und eignet sich daher perfekt für den Einsatz in Werkzeugen, die unter extrem kalten Bedingungen benötigt werden, wie z. B. Kryopumpen und Hochvakuumsysteme. Eine weitere einzigartige Eigenschaft ist seine Klebrigkeit, die es als Lötmittel sehr nützlich macht.
Indium wird zur Herstellung verschiedener elektrischer Geräte wie Gleichrichter (Geräte, die einen Wechselstrom in einen Gleichstrom umwandeln), Thermistoren (ein von der Temperatur abhängiger elektrischer Widerstand) und Fotoleiter (Geräte, die ihre elektrische Leitfähigkeit erhöhen, wenn sie Licht ausgesetzt werden) verwendet.
Quelle & Häufigkeit
Indium kommt in der Natur selten ungebunden vor und ist typischerweise in Zink-, Eisen-, Blei- und Kupfererzen enthalten. Es ist das 61. häufigste Element in der Erdkruste und etwa dreimal häufiger als Silber oder Quecksilber, nach dem US Geological Survey (USGS). Es wird geschätzt, dass es etwa 0,1 Teile pro Million (ppm) in der Erdkruste ausmacht. Nach Gewicht wird Indium laut Chemicool auf 250 Teile pro Milliarde (ppb) geschätzt. Natürliches Indium ist eine Mischung der Isotope I-115 (95,72 Prozent) und I-113 (4,28 Prozent), nach Encyclopaedia Britannica.
Das meiste kommerzielle Indium kommt aus Kanada und liegt bei rund 75 Tonnen pro Jahr. Die Reserven des Metalls werden auf über 1.500 Tonnen geschätzt. Kultivierte Böden sind manchmal reicher an Indium als nicht kultivierte Böden mit einigen Niveaus so hoch wie 4 ppm, nach Lenntech.
Wer wusste das?
- Indiummetall gibt beim Biegen einen hohen „Schrei“ ab. Ähnlich wie der „Blechschrei“ klingt dieser Schrei eher wie ein knisterndes Geräusch.
- Indium ähnelt Gallium insofern, als es Glas leicht benetzt und sehr nützlich für die Herstellung niedrigschmelzender Legierungen ist. Eine Legierung aus 24 Prozent Indium und 76 Prozent Gallium ist bei Raumtemperatur flüssig.
- Die erste großflächige Indiumanwendung war laut USGS eine Beschichtung für Lager in Hochleistungsflugzeugtriebwerken im Zweiten Weltkrieg.
- Proben von ungebundenem Indiummetall wurden laut Lenntech in einer Region Russlands gefunden.
Bessere Batterien
Die Indiumbeschichtung könnte eines Tages zu leistungsstärkeren und langlebigeren wiederaufladbaren Lithiumbatterien führen, so eine in der Zeitschrift Angewandte Chemie veröffentlichte Studie. Die Indiumbeschichtung würde eine gleichmäßigere Ablagerung von Lithium während des Ladevorgangs ermöglichen, negative Nebenreaktionen abpuffern und die Speicherkapazität erhöhen.
Eine Lithium-Ionen-Batterie ist eine Art wiederaufladbare Batterie, die üblicherweise in tragbaren Technologien wie Mobiltelefonen und Laptops verwendet wird. Während der Entladung bewegen sich die Lithiumionen von der negativen Elektrode (Anode) zur positiven Elektrode (Kathode). Während die Batterie geladen wird, bewegen sich die Lithiumionen in die entgegengesetzte Richtung — die negative Elektrode wird zur Kathode und die positive Elektrode wird zur Anode.
Derzeit verwenden Lithium-Ionen-Batterien Anoden aus Graphit, die zum Speichern von Lithium beim Laden der Batterie verwendet werden. Eine vielversprechende Alternative zur Verwendung von Graphit wären metallische Anoden — wie Lithiummetall -, die eine viel größere Speicherkapazität bieten könnten. Ein Hauptproblem bei der Verwendung von Metallanoden besteht jedoch darin, dass sich das Metall während des Ladevorgangs der Batterie ungleichmäßig ablagert. Dies führt zur Bildung von Dendriten (einer Kristallmasse mit einer verzweigten baumartigen Struktur). Nach längerem Gebrauch werden diese Dendriten so groß, dass sie die Batterie kurzschließen.
Ein weiteres Problem bei metallischen Anoden besteht darin, dass sie unerwünschte Nebenreaktionen zwischen den reaktiven Metallelektroden und dem Elektrolyten (dem Material, das den Stromfluss zwischen positiven und negativen Elektroden ermöglicht) verursachen. Diese Reaktionen können die Lebensdauer der Batterie erheblich verkürzen.
Forscher des Rensselaer Polytechnic Institute und der Cornell University haben eine neue Alternative vorgestellt: Die Beschichtung des Lithiums in einer Indiumsalzlösung. Die Indiumschicht ist gleichmäßig und selbstheilend, wenn die Elektrode verwendet wird. Seine chemische Zusammensetzung bleibt gleich und es bleibt während der Lade- / Entladezyklen intakt, wodurch Nebenreaktionen verhindert werden, so die Pressemitteilung der Studie in Science Daily. Dendriten werden ebenfalls eliminiert, sodass die Oberfläche glatt und kompakt bleibt.