L’indium est un métal argenté brillant qui est si doux et malléable qu’il peut être rayé avec un ongle et plié dans presque toutes les formes. Dans la nature, l’indium est assez rare et se trouve presque toujours comme oligo—élément dans d’autres minéraux — en particulier dans le zinc et le plomb – à partir desquels il est généralement obtenu comme sous-produit. Son abondance estimée dans la croûte terrestre est de 0,1 partie par million (ppm) — un peu plus abondante que l’argent ou le mercure, selon la Royal Society of Chemistry.
L’indium a un point de fusion bas pour un métal : 313.9 degrés Fahrenheit (156,6 degrés Celsius). À tout ce qui dépasse cette température, il brûle avec une flamme violette ou indigo. Le nom de l’indium est dérivé de la brillante lumière indigo qu’il montre dans un spectroscope.
Juste les faits
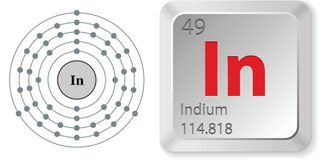
- Numéro atomique (nombre de protons dans le noyau): 49
- Symbole atomique (sur le tableau périodique des éléments): En
- Poids atomique (masse moyenne de l’atome): 114.8.8
- Densité: 7,31 grammes par centimètre cube
- Phase à température ambiante: Solide
- Point de fusion: 313,88 degrés F (156.6 degrés C)
- Point d’ébullition: 3 761,6 F (2 072 C)
- Nombre d’isotopes (atomes du même élément avec un nombre différent de neutrons): 35 dont les demi-vies sont connues; 1 stable; 2 d’origine naturelle
- Isotope le plus commun: Dans-115
Découverte
L’indium a été découvert en 1863 par le chimiste allemand Ferdinand Reich à l’École des Mines de Freiberg en Allemagne. Reich étudiait un échantillon d’un mélange de minéraux de zinc qui, selon lui, pourrait contenir l’élément thallium récemment découvert. Après avoir torréfié le minerai pour éliminer la majeure partie du soufre, il a appliqué de l’acide chlorhydrique sur les matériaux restants. Il a ensuite observé l’apparition d’un solide jaunâtre. Il soupçonnait qu’il pourrait s’agir du sulfure d’un nouvel élément, mais comme il était daltonien, il a demandé à son collègue chimiste allemand Hieronymous T. Richter d’examiner le spectre de l’échantillon. Richter a noté une ligne brillante de couleur violette, qui ne correspondait à la raie spectrale d’aucun élément connu.
En travaillant ensemble, les deux scientifiques ont isolé un échantillon du nouvel élément et annoncé sa découverte. Ils ont nommé le nouvel élément indium, d’après le mot latin indicum, qui signifie violet. Malheureusement, leur relation a tourné au vinaigre lorsque Reich a appris que Richter avait prétendu être le découvreur, selon la Royal Society of Chemistry (RSC).
Utilisations
Plus d’un siècle après la découverte de l’indium, l’élément était toujours dans une relative obscurité car personne ne savait quoi en faire. Aujourd’hui, l’indium est vital pour l’économie mondiale sous forme d’oxyde d’indium et d’étain (ITO). En effet, ITO reste le meilleur matériau pour répondre au besoin croissant de LCD (écrans à cristaux liquides) dans les écrans tactiles, les téléviseurs à écran plat et les panneaux solaires.
ITO possède plusieurs propriétés qui le rendent parfait pour les écrans LCD et autres écrans plats: Il est transparent, conduit l’électricité, adhère fortement au verre, résiste à la corrosion et est chimiquement et mécaniquement stable.
ITO est également couramment utilisé pour fabriquer des revêtements minces pour le verre et les miroirs. Lorsqu’il est enduit sur les pare-brise des avions ou des voitures, par exemple, ITO permet au verre de dégivrer ou de se vaporiser, et il peut réduire les besoins en climatisation.
La demande croissante pour les écrans LCD a considérablement augmenté les prix de l’indium ces dernières années, selon le RSC. Cependant, le recyclage et l’efficacité de la fabrication ont contribué à créer un bon équilibre entre l’offre et la demande.
L’indium est couramment utilisé pour fabriquer des alliages et est souvent appelé « vitamine métallique », ce qui signifie que de minuscules niveaux d’indium peuvent faire une différence radicale dans un alliage, selon le RSC. Par exemple, l’ajout de petites quantités d’indium aux alliages d’or et de platine les rend beaucoup plus difficiles. Les alliages d’indium sont utilisés pour revêtir les roulements des moteurs à grande vitesse et d’autres surfaces métalliques. Ses alliages à faible fusion sont également utilisés dans les têtes d’arrosage, les maillons de porte coupe-feu et les bouchons fusibles.
L’indium reste exceptionnellement doux et malléable à très basse température, ce qui le rend parfait pour une utilisation dans des outils nécessaires dans des conditions extrêmement froides, tels que les pompes cryogéniques et les systèmes à vide poussé. Une autre qualité unique est son caractère collant, ce qui le rend très utile comme soudure.
L’indium est utilisé dans la fabrication de divers appareils électriques tels que les redresseurs (dispositifs qui convertissent un courant alternatif en courant continu), les thermistances (une résistance électrique dépendante de la température) et les photoconducteurs (dispositifs qui augmentent leur conductivité électrique lorsqu’ils sont exposés à la lumière).
Source & abondance
L’indium est rarement trouvé non combiné dans la nature et se trouve généralement dans les minerais de zinc, de fer, de plomb et de cuivre. C’est le 61e élément le plus commun de la croûte terrestre et environ trois fois plus abondant que l’argent ou le mercure, selon l’US Geological Survey (USGS). On estime qu’elle représente environ 0,1 partie par million (ppm) dans la croûte terrestre. En poids, l’indium est estimé à 250 parties par milliard (ppb), selon Chemicool. L’indium naturel est un mélange des isotopes I-115 (95,72%) et I-113 (4,28%), selon l’Encyclopaedia Britannica.
La majeure partie de l’indium commercial provient du Canada et représente environ 75 tonnes par année. Les réserves de métal sont estimées à plus de 1 500 tonnes. Les sols cultivés s’avèrent parfois plus riches en indium que les sols non cultivés avec des niveaux pouvant atteindre 4 ppm, selon Lenntech.
Qui savait ?
- Le métal indium émet un « cri » aigu lorsqu’il est plié. Semblable au « cri d’étain », ce cri ressemble plus à un crépitement.
- L’indium est similaire au gallium en ce qu’il mouille facilement le verre et est très utile pour la fabrication d’alliages à faible fusion. Un alliage composé de 24% d’indium et de 76% de gallium est liquide à température ambiante.
- La première application à grande échelle d’indium a été un revêtement de roulements dans des moteurs d’avions à hautes performances pendant la Seconde Guerre mondiale, selon l’USGS.
- Des spécimens de métal indium non combiné ont été trouvés dans une région de Russie, selon Lenntech.
De meilleures batteries
Le revêtement à l’indium pourrait un jour conduire à des batteries au lithium rechargeables plus puissantes et plus durables, selon une étude publiée dans la revue Angewandte Chemie. Le revêtement d’indium offrirait un dépôt plus uniforme du lithium pendant la charge, tamponnerait les réactions secondaires négatives et augmenterait le stockage.
Une batterie lithium-ion est un type de batterie rechargeable couramment utilisée dans les technologies portables, telles que les téléphones portables et les ordinateurs portables. Pendant la décharge, les ions lithium se déplacent de l’électrode négative (anode) à l’électrode positive (cathode). Pendant la charge de la batterie, les ions lithium se déplacent dans la direction opposée — l’électrode négative devient la cathode et l’électrode positive devient l’anode.
Actuellement, les batteries lithium-ion utilisent des anodes en graphite qui sont utilisées pour stocker le lithium lorsque la batterie est chargée. Une alternative prometteuse à l’utilisation du graphite serait les anodes métalliques – telles que le lithium métal – qui pourraient offrir une capacité de stockage beaucoup plus grande. Cependant, un problème majeur avec l’utilisation d’anodes métalliques est qu’il y a un dépôt inégal du métal pendant la charge de la batterie. Cela conduit à la formation de dendrites (une masse cristalline avec une structure arborescente ramifiée). Après une utilisation prolongée, ces dendrites deviennent si grosses qu’elles court-circuitent la batterie.
Un autre problème avec les anodes métalliques est qu’elles provoquent des réactions secondaires indésirables entre les électrodes métalliques réactives et l’électrolyte (le matériau qui permet à l’électricité de circuler entre les électrodes positives et négatives). Ces réactions peuvent réduire considérablement la durée de vie de la batterie.
Des chercheurs de l’Institut polytechnique Rensselaer et de l’Université Cornell ont introduit une nouvelle alternative: le revêtement du lithium dans une solution de sel d’indium. La couche d’indium est uniforme et auto-cicatrisante lorsque l’électrode est utilisée. Sa composition chimique reste la même et elle reste intacte pendant les cycles de charge / décharge, empêchant les réactions secondaires, selon le communiqué de presse de l’étude dans Science Daily. Les dendrites sont également éliminées, ce qui permet à la surface de rester lisse et compacte.