Es ist seit langem bekannt, dass Patienten mit kleinzelligem Lungenkrebs neurologische Anzeichen und Symptome mit erhöhter Häufigkeit entwickeln .
Wie genau Krebserkrankungen zu paraneoplastischen neurologischen Symptomen führen, ist unvollständig verstanden. Die Entwicklung dieser Syndrome ist nicht auf eine direkte Tumorinvasion zurückzuführen. Die Expression von onkoneuralen Antigenen durch die Krebszellen, die zu Autoimmunität führen, scheint der Mechanismus zu sein. Die klassischen paraneoplastischen Antikörper richten sich gegen intrazelluläre Antigene und sind möglicherweise nicht direkt pathogen. Passive Transferversuche waren im Allgemeinen erfolglos. Antikörper, die gegen exponierte Antigene gerichtet sind, nämlich ganglionäre Acetylcholinrezeptoren und spannungsgesteuerte Calcium- und Kaliumkanäle, erscheinen jedoch direkter pathogen. Mit diesen Antikörpertypen waren mehrere passive Transferexperimente positiv, was die direkte pathogene Wirkung der Antikörper bestätigte.
Autoantikörper gegen diese extrazellulär exponierten Membranproteine treten häufig ohne zugrunde liegende Malignität auf. Eine Suche nach einer Malignität sollte noch durchgeführt werden, aber diese Bedingungen können durch einen idiopathischen Autoimmunprozess auftreten.
Bisher wurden viele antineuronale Antikörper beschrieben, und jedes Jahr werden neue Antikörper beschrieben. Manchmal wird mehr als 1 Antikörpertyp bei einem einzelnen Patienten gefunden, und derselbe Antikörpertyp kann bei anderen Patienten mit sehr unterschiedlichen Syndromen assoziiert sein. Es ist auch durchaus möglich, dass ein Patient, dem identifizierbare Autoantikörper fehlen, der jedoch einen Tumor aufweist, von dem bekannt ist, dass er Epitope exprimiert, die neuronalen Strukturen ähnlich sind (z. B. kleinzelliger Lungenkrebs), aufgrund eines nicht identifizierten Antikörpers an einer paraneoplastischen autonomen Dysfunktion leidet.
Eine autonome Dysfunktion kann auftreten, wenn dieser Autoimmunprozess das autonome Nervensystem ausreichend schädigt. Es liegen nur begrenzte Daten zum Immunangriff auf präganglionäre Neuronen oder zentrale autonome Bahnen vor. Typische pathologische Veränderungen sind lymphozytäre Infiltrate und Gefäßmanschetten; wie im Bild unten aus einem Fall von Anti-Hu-Enzephalomyeloneuropathie gezeigt. Ähnliche Angriffe auf autonome postganglionäre und myenteriale Neuronen können mit antineuronalen Antikörpern auftreten.
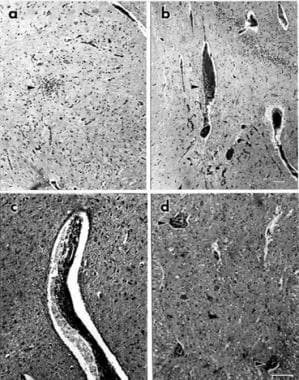 Paraneoplastische autonome Neuropathie. Zentralnervensystemschnitte eines Patienten mit autonomem Versagen, Haferzellkarzinom der Lunge und positivem Titer von mit Hämatoxylin und Eosin gefärbten Anti-HU-Antikörpern (H & E). (a) Untere Olive mit einer Ansammlung mononukleärer Zellen (Pfeilspitze); (b) Hippocampus mit perivaskulärem mononukleärem Infiltrat (Pfeilspitze); (c) Mittelhirnabschnitt mit einem Gefäß, das von einem mononukleären Infiltrat umgeben ist; (d) ventrales Horn des thorakalen Rückenmarks mit Clustern mononukleärer Zellen um degenerierende Motoneuronen (Pfeilspitzen). Vergrößerungsbalken zeigen 100 mm an. Der Balken in b gilt auch für a und der Balken in d gilt auch für c.
Paraneoplastische autonome Neuropathie. Zentralnervensystemschnitte eines Patienten mit autonomem Versagen, Haferzellkarzinom der Lunge und positivem Titer von mit Hämatoxylin und Eosin gefärbten Anti-HU-Antikörpern (H & E). (a) Untere Olive mit einer Ansammlung mononukleärer Zellen (Pfeilspitze); (b) Hippocampus mit perivaskulärem mononukleärem Infiltrat (Pfeilspitze); (c) Mittelhirnabschnitt mit einem Gefäß, das von einem mononukleären Infiltrat umgeben ist; (d) ventrales Horn des thorakalen Rückenmarks mit Clustern mononukleärer Zellen um degenerierende Motoneuronen (Pfeilspitzen). Vergrößerungsbalken zeigen 100 mm an. Der Balken in b gilt auch für a und der Balken in d gilt auch für c. Die am besten verstandenen Syndrome mit paraneoplastischer autonomer Dysfunktion sind paraneoplastische autoimmune autonome Gangliopathie (AAG), paraneoplastische sensorische Neuropathie und / oder Neuronopathie, paraneoplastische Enzephalomyeloneuropathie und Lambert-Eaton myasthenisches Syndrom.
Antiganglionäre Acetylcholinrezeptor-Antikörper
Diese Antikörper, die gegen nikotinisches Acetylcholin in Rezeptoren gerichtet sind, die die α3-Untereinheit enthalten, die auf sympathischen und parasympathischen Ganglien exprimiert wird, verursachen paraneoplastische AAG. Ganglionäre Acetylcholinrezeptor-Antikörper binden nicht an Muskelacetylcholinrezeptoren und es ist nicht bekannt, dass sie Myasthenia gravis (MG) verursachen. Diese antiganglionären Acetylcholinrezeptor-Antikörper sind wahrscheinlich direkt pathogen und weisen ein assoziiertes klinisches Bild auf, das normalerweise durch autonomes Versagen gekennzeichnet ist. Nur etwa 20% der Fälle mit AAG scheinen paraneoplastischen Ursprungs zu sein und beziehen sich auf kleinzelliges Lungenkarzinom, Thymom, Blasenkarzinom und Rektumkarzinom ; Viele der verbleibenden Fälle scheinen postinfektiöse Analoga des Gullian-Barre-Syndroms zu sein. Ein Fall von paraneoplastischer AAG, der mit Antikörpern gegen Muskelacetylcholinrezeptoren koexistiert, wurde berichtet.
Anti-Hu
Anti-Hu-Antikörper (die auch als antineuronale nukleare Antikörper Typ 1 bezeichnet werden ) sind die zweitwichtigsten für autonome Dysfunktion; und werden oft im Rahmen von kleinzelligem Lungenkrebs gesehen. Diese Antikörper können auch bei nichtkleinzelligem Lungenkrebs, Neuroblastom und malignen Erkrankungen des Gastrointestinaltrakts, der Prostata, der Brust, der Blase, der Niere, der Bauchspeicheldrüse, des Hodens und des Eierstocks beobachtet werden. Die Autoimmunantwort ist auf das Hu-Antigen gerichtet, eine AU-reiche 3′-untranslatierte m-RNA-Sequenz, die von vielen kleinzelligen Lungenkrebszellen und von allen Neuronen exprimiert wird.
Antikörper gegen das Hu Onconeuronal-Antigen können fast jeden Teil des Zentralnervensystems (ZNS) oder des peripheren Nervensystems betreffen. Der Anti-Hu-Antikörper ist am häufigsten mit einer paraneoplastischen sensorischen Neuronopathie assoziiert, bei der primäre sensorische Neuronen zerstört werden. Wenn Anti-Hu vorhanden ist, haben etwa 25% der Patienten eine Form von Dysautonomie, am häufigsten gastrointestinale Manifestationen. Dieser Antikörper ist diagnostisch nützlich, aber die genaue Rolle der humoralen Immunität bei der Entstehung neuronaler Degeneration bleibt ungewiss.
Anti-NMDA-Rezeptor
Es wurde festgestellt, dass ein kürzlich entdeckter Antikörper gegen den NMDA-Rezeptor mit Psychosen, Krampfanfällen und autonomer Instabilität assoziiert ist. In einer Fallserie wurde festgestellt, dass es die Ursache für 4% der Enzephalitis-Fälle ist. Der Antikörper wird in 94% der Fälle in Liquor cerebrospinalis (CSF) gefunden. In einer Fallserie wurde bei 55% der Patienten ein Teratom gefunden, das neurales Gewebe mit exprimierten NMDA-Rezeptoren enthielt. Typischerweise ist der Tumor ein Eierstock-Teratom; Es wurden jedoch auch Hodenkeimzelltumoren, Neuroblastome und Hodgkin-Lymphome berichtet. Es gibt Hinweise darauf, dass eine NMDA-Rezeptor-Antikörper-Enzephalitis zu einer zentral vermittelten Sinusknotendysregulation einschließlich Herzstillstand führen kann.
Anti-VGCC
Beim Lambert-Eaton-myasthenischen Syndrom (LEMS) sind Antikörper gegen spannungsgesteuerte Calciumkanäle vom P / Q-Typ (VGCC) vorhanden. Diese Antikörper führen zu einer gestörten präsynaptischen Calciumfreisetzung am neuromuskulären Übergang, was zu einer überwiegend proximalen Muskelschwäche führt. Diese Antikörper blockieren nicht nur die spannungsgesteuerten Kalziumkanäle am neuromuskulären Übergang, sondern auch an parasympathischen und sympathischen Nervenenden, wodurch autonome Insuffizienz und autonome Symptome entstehen. Dieses Syndrom ist in 50-60% der Fälle mit Malignität verbunden, typischerweise mit kleinzelligem Lungenkrebs, aber auch mit nichtkleinzelligem Lungenkrebs, malignem Thymom, Lymphom, Leukämie und Karzinomen der Brust, Prostata, Kehlkopf und Gallenblase. Autonome Dysfunktion bei LEMS ist normalerweise mild.
Andere paraneoplastische Antikörper
Das Collapsin-Response-Mediator-Protein (CRMP-5), auch bekannt als CV-2, ist ein weiterer paraneoplastischer Antikörper, der in 33% der Fälle eine autonome Dysfunktion aufweist. CRMP-5 wird am häufigsten bei kleinzelligem Lungenkrebs beobachtet. Purkinje-Zell-Antikörper-2 (PCA-2) verursacht häufig Kleinhirndegeneration, kann aber auch mit autonomem Versagen assoziiert sein. Antikörper gegen Synaptophysin können mit Lungenkrebs und gastrointestinalen Störungen des Plexus myentericus assoziiert sein. Es wurde berichtet, dass spannungsgesteuerte Kaliumkanal (VGKC) -Antikörper in 33% der Fälle autonomes Versagen verursachen. VGKC-Antikörper sind mit neuroendokrinen Tumoren assoziiert, einschließlich kleinzelligem Lungenkarzinom, Retinoblastom, Oligodendrogliom, Melanom, Leiomyosarkom und hämatologischen Malignomen. . Es gibt einen VGKC-Antikörper-Komplex, der mit dem Contractin Associate Protein 2 (CASPR2) assoziiert ist und bei autonomer Dysfunktion mit Thymom oder kleinzelligem Lungenkrebs beobachtet wurde.
Magen-Dysmotilität paraneoplastische Störungen können häufig mit Antikörpern wie Anti-Yo, Anti-Hu, Anti-Ganglion-Acetylcholin-Rezeptor, CRMP-5, Anti-VGCC, Anti-VGKC, GAD65, Inselzell-Antigen 512 (IA-2), Magen-Parietal-Zelle, Muskel-Striational, Schilddrüsen-Peroxidase oder Thyreoglobulin-Autoantikörper gesehen werden. . Ein Fallbericht dokumentiert einen Patienten mit funktioneller Kolonobstruktion, der letztendlich aus einer paraneoplastischen Augenmyasthenie in Verbindung mit einem Thymom resultiert.
Es wurde berichtet, dass das Stiff-Person-Syndrom, wenn es durch eine paraneoplastische Störung verursacht wird (etwa 5% der Fälle), mit Anti-GAD65, Amphiphysin-Antikörpern, Anti-Ri (ANNA-2-Antikörper), Anti-Gephyrin, Anti-ICA 105 und Anti-17-B-Hydroxysteroid-Dehydrogenase Typ 4 assoziiert ist. Assoziierte Tumoren treten bei Brust-, Thymus-, Lungen- und Nierenkrebs sowie beim multiplen Myelom auf.
Bei progressiver Enzephalomyelitis mit Rigidität und Myoklonus (PERM) wurde bei 20% der mit Anti-Ri (ANNA-2), Anti-Amphiphysin und Anti-GAD65 assoziierten Patienten eine paraneoplastische Ursache festgestellt. Autonome Symptome wie Pyrexie und Diaphorese treten bei 66% der Patienten mit PERM auf.
Anti-Yo, auch bekannt als Purkinje-Zell-Antikörper 1 (PCA-1), ist mit Brust-, Eierstock-, Eileiter- oder Gebärmutterkrebs assoziiert. Es zielt auf ein intrazelluläres Antigen namens CDR2. Die typische Präsentation ist Magen-Dysmotilität.
Viele andere Autoantikörper können auch eine Rolle bei der paraneoplastischen Dysautonomie spielen, wobei jedes Jahr mehr gefunden werden. Neuere Beispiele umfassen Synaptophysin, SOX, ZIC, Anti-AMPA und Anti-GABA sowie Antikörper gegen Inositol-1,4,5-Trisphosphatrezeptor Typ 1 (ITRP1) und Dipeptidylpeptidase-ähnliches Protein-6 (DPP6, auch bekannt als DPPX).
Die Autoimmunität bei paraneoplastischen neurologischen Syndromen scheint einen gewissen Grad an Antitumorwirkung zu verleihen. Eine Entzündung ähnlich der im Nervensystem wirkt sich auch auf den Tumor aus.
Es wurden mehrere Fälle berichtet, in denen Hu-Antikörper mit klassischen paraneoplastischen Symptomen aufgetreten sind, die spontan abgeklungen sind, ohne dass ein zugrunde liegender Tumor identifiziert wurde. Dies könnte auf eine spontane Heilung des zugrunde liegenden Krebses zurückzuführen sein, möglicherweise auf eine Antitumorwirkung der paraneoplastischen Antikörper.