- Introducción
- Experimento 1
- Métodos
- Participantes
- Aparato y tarea
- Fases experimentales y Procedimiento
- Análisis de datos
- Resultados
- Tiempo de movimiento total
- Tiempo relativo
- Discusión
- Experimento 2
- Métodos
- Participantes
- Aparato, Tarea, Fases Experimentales, Procedimiento y Análisis de Datos
- Resultados
- Tiempo de Movimiento total
- Tiempo relativo
- Discusión
- Discusión general
- Contribuciones de los autores
- Financiación
- Declaración de Conflicto de Intereses
- Notas a pie de página
Introducción
Usted es un ávido golfista y desea aprender un nuevo tiro. ¿Cómo proceder? Existe una buena posibilidad de que observes a alguien (en vivo, en video, en Youtube, etc.).) quién sabe cómo realizar esta toma, y usted tratará de entender qué hacer y cómo hacerlo. La investigación indica claramente que esta estrategia de aprendizaje es exitosa porque se ha demostrado que la observación promueve el aprendizaje de una amplia variedad de habilidades motoras (ver McCullagh et al., 1989; Hodges et al., 2007; Vogt y Thomaschke, 2007; Ste-Marie et al., 2012; Lago-Rodríguez et al., 2014, para reseñas sobre el aprendizaje observacional). Esto se debe a que la observación tiene mucho en común con la práctica física, que es el primer determinante del aprendizaje de habilidades motoras. En concreto, se ha demostrado que variables como la cantidad de práctica (Carroll y Bandura, 1990; Blandin, 1994), la frecuencia del conocimiento de los resultados (, Badets y Blandin, 2004, 2005; Badets et al., 2006), y el calendario de prácticas (Blandin et al., 1994; Wright et al., 1997), afectan el aprendizaje a través de la práctica observacional y la práctica física de maneras similares. Estos datos llevaron a la proposición de que la observación y la práctica física utilizan procesos muy similares. Esta proposición está respaldada por los resultados de estudios de neuroimagen que mostraron que un conjunto de estructuras neuronales (incluyendo la corteza premotora, el lóbulo parietal inferior, el surco temporal superior, el área motora suplementaria, el giro cingulado y el cerebelo), también llamado «red de observación de acción» (AON) (Kilner et al., 2009; Oosterhof et al., 2010), se activa tanto cuando los individuos realizan una tarea motora dada como cuando observan a otros realizando esa misma tarea motora (Grafton et al., 1997; Buccino et al., 2001; Gallese et al., 2002; Cisek y Kalaska, 2004; Frey y Gerry, 2006; Cross et al., 2009; Dushanova y Donoghue, 2010; Rizzolatti y Fogassi, 2014; Rizzolatti et al., 2014).
La observación favorece el aprendizaje de habilidades motoras, pero ¿a quién debes observar para aprender ese nuevo tiro de golf? Un experto que domine la toma presumiblemente le ayudará a desarrollar una referencia de qué hacer y cómo hacerlo, pero ¿debe observar a alguien como usted que está aprendiendo esa toma y que presumiblemente le da una mejor oportunidad de detectar y aprender de errores o cambios en la estrategia? La investigación ha demostrado que la observación de ambos es un modelo experto (Martens et al., 1976; McCullagh et al., 1989; Lee et al., 1994; Al-Abood et al., 2001; Heyes y Foster, 2002; Hodges et al., 2003; Bird y Heyes, 2005) y un modelo novato conduce a un aprendizaje significativo (Lee y White, 1990; McCullagh y Caird, 1990; Pollock y Lee, 1992; McCullagh y Meyer, 1997; Black y Wright, 2000; Buchanan et al., 2008; Buchanan y Dean, 2010; Hayes et al., 2010). Sin embargo, los resultados recientes de nuestro laboratorio mostraron que el aprendizaje observacional de una nueva habilidad motora mejora después de la observación de modelos novatos y expertos en lugar de un modelo novato o experto solo (Rohbanfard y Proteau, 2011; Andrieux y Proteau, 2013, 2014). Creemos que este formato de observación «variable» conduce no solo al desarrollo de una buena representación del movimiento (observación experta), sino también al desarrollo de procesos eficientes para la detección y corrección de errores (observación novata).
En el presente estudio, la cuestión de interés es simple pero importante. Cuando se utiliza un horario de observación variable, el aprendizaje será mejor cuando se informe a los observadores de antemano de la «calidad» de la actuación que están a punto de ver, o será mejor cuando se deje que los observadores evalúen las actuaciones antes de recibir retroalimentación. Informar a los observadores de lo que están a punto de ver puede permitirles seleccionar si observarán para imitar o más bien observarán para detectar errores o debilidades en el desempeño del modelo, lo que podría facilitar el desarrollo de estos procesos. Alternativamente, hacer que los participantes evalúen la calidad del desempeño que observaron puede activar procesos cognitivos más elaborados que cuando se alimenta esta información (por ejemplo, detección y reconocimiento de errores, o evaluación de estrategias alternativas), lo que resulta en un mejor aprendizaje de la tarea.
La tarea que elegimos requería que los participantes cambiaran el patrón de tiempo relativo que emergía naturalmente de las restricciones de la tarea (Collier y Wright, 1995; Blandin et al., 1999) a un nuevo patrón de tiempo relativo impuesto. Esto es similar a cambiar el tempo al ejecutar un saque en el tenis o un drive en el golf (Rohbanfard y Proteau, 2011). Los participantes observaron dos modelos que demostraban una amplia variedad de actuaciones. En un grupo, se informó a los observadores antes de cada ensayo del nivel de calidad (rendimiento experto, avanzado, intermedio, novato o principiante) de lo que estaban a punto de ver, mientras que a un segundo grupo de observadores se le proporcionó la misma información solo después de que se completó cada ensayo de observación.
Experimento 1
Métodos
Participantes
Noventa estudiantes diestros (45 hombres y 45 mujeres; edad media = 20,5 años; DE = 0,9 años) del Departamento de Medicina de la Universidad de Montreal participaron en este experimento. Los participantes eran ingenuos para el propósito del estudio y no tenían experiencia previa con la tarea, y todos los participantes se declararon diestros. Ninguno de los participantes informó de trastornos neurológicos, y todos tenían visión normal o corregida a normal. Los participantes completaron y firmaron formularios de consentimiento individual antes de la participación. El Comité de Ética en Investigación en Ciencias de la Salud de la Universidad de Montreal aprobó este experimento.
Aparato y tarea
El aparato era similar al utilizado por Rohbanfard y Proteau (2011). Como se ilustra en la Figura 1, consistía en una base de madera (45 × 54 cm), tres barreras de madera (11 × 8 cm) y un botón de arranque incrustado en un objetivo (11 × 8 cm). La distancia entre el botón de arranque y la primera barrera era de 15 cm. Las distancias de los tres segmentos restantes de la tarea fueron de 32, 18 y 29 cm, respectivamente. Las barreras se colocaron perpendiculares a la base de madera al comienzo de cada ensayo, dando lugar a un circuito cerrado de microinterruptores. Todos los microinterruptores se conectaron a una computadora a través del puerto de E/S de un convertidor A–D (National Instruments, Austin, Texas, EE.UU.), y se usó un temporizador de milisegundos para registrar tanto el tiempo total de movimiento (TMT) como el tiempo requerido para completar cada segmento de la tarea (tiempos intermedios, ITS).FIGURA
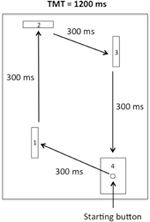
Gráfico 1 Boceto del aparato. Los participantes tuvieron que abandonar el botón de inicio y golpear la primera, segunda y tercera barreras en el sentido de las agujas del reloj antes de finalmente alcanzar el objetivo.
Para las pruebas de práctica física (ver más abajo), los participantes se sentaron cerca de la posición inicial frente al aparato. Luego, desde el botón de inicio, se pidió a los participantes que derribaran sucesivamente la primera, segunda y tercera barreras (liberando así los microinterruptores) y finalmente golpearan el objetivo en el sentido de las agujas del reloj, como se ilustra en la Figura 1. Cada segmento de la tarea debía completarse en un TI de 300 ms, para un TMT de 1200 ms. El patrón de movimiento, ITs y TMT se ilustraron en un póster ubicado directamente frente al aparato durante todas las fases experimentales.
Fases experimentales y Procedimiento
Los participantes se asignaron aleatoriamente a uno de los tres grupos, cada uno de ellos compuesto por 30 participantes (15 mujeres por grupo): control (C), KR de retroalimentación y observación (FW) y observación y retroalimentación KR (FB). Todos los grupos realizaron cuatro fases experimentales, repartidas en 2 días consecutivos.
Todos los participantes recibieron instrucciones verbales sobre TMT y ITs antes de la primera fase experimental. La primera fase experimental fue una prueba previa, en la que todos los participantes realizaron 20 ensayos de práctica física sin conocimiento de los resultados (KR) en el TMT y el ITs.
La segunda fase fue una fase de adquisición y consistió en 60 ensayos de observación para los participantes de los dos grupos de observación (FW y FB). Estos participantes vieron individualmente una presentación en video de dos modelos que realizaban físicamente la tarea experimental. Para cada ensayo de observación, el KR relativo al rendimiento del modelo (tanto TMT como ITs) se presentó en em (véase la Figura 1), ya sea antes de la demostración para el grupo FW o después de la demostración para el grupo FB. El modelo se cambió cada cinco ensayos (es decir, modelo 1: ensayos 1-5 y modelo 2: ensayos 6-10, etc.), para un total de 30 ensayos realizados por un modelo y 30 ensayos realizados por el otro modelo. Para los grupos FW y FB, se eligieron las dos modelos, que participaron en trabajos anteriores de nuestro laboratorio, porque para ambas modelos, teníamos seis videoclips que ilustraban actuaciones en cada una de las cinco subcategorías. Por lo tanto, los participantes en los grupos FW y FB no pudieron asociar un modelo en particular con un mejor o peor desempeño. El rendimiento de un experto correspondía a un error cuadrático medio de raíz (RMSE; consulte la sección análisis de datos para obtener detalles de cálculo) que oscilaba entre 0 y 15 ms; el rendimiento avanzado, intermedio, principiante y principiante correspondió a RMSEs de 30-45 ms, 60-75 ms, 90-105 ms y 120+ ms, respectivamente. Se informó a los participantes de los grupos FW y FB del desempeño del modelo en em; también se les informó del nivel de desempeño al que se refería. Los 30 ensayos resultantes de cada modelo (cinco niveles de rendimiento × seis repeticiones) se aleatorizaron para que los cinco niveles de rendimiento se presentaran una vez en cada conjunto de cinco ensayos. Para evitar la imitación física de la secuencia, que podría interferir con los procesos de observación, se pidió a los participantes de los grupos FW y FB que mantuvieran las manos en los muslos durante la fase de adquisición y que no reprodujeran los movimientos mientras observaban los modelos. La tarea principal del Experimentador era asegurarse de que los participantes cumplieran con estas instrucciones. El comportamiento manifiesto de los participantes sugiere que lo hicieron. Finalmente, los participantes del grupo de control no practicaron físicamente ni observaron nada durante esta fase. En su lugar, leen un periódico o revista que se les proporciona durante la misma duración que la observación para los otros grupos (aproximadamente 10 minutos).
La tercera y cuarta fase experimental fueron fases de retención de 10 min y 24 h. En cada fase, todos los participantes realizaron físicamente 20 ensayos sin RK. Se pidió a los participantes que completaran cada segmento de la tarea en 300 ms, para un TMT de 1200 ms.
Análisis de datos
Los datos de la prueba previa y las dos fases de retención se reagruparon en bloques de cinco ensayos. Para cada bloque sucesivo de cinco ensayos (p. ej., ensayos 1-5, 6-10, etc.), calculamos el valor absoluto del error constante de cada participante (|CE|, el error constante indica si un participante superó o superó el tiempo total de movimiento) y el error variable del tiempo total de movimiento (VE o variabilidad dentro del participante) para determinar la precisión y consistencia de la TMT, respectivamente. Para tiempos intermedios, calculamos un RMSE, que indica cuánto se desvió cada participante del patrón de tiempo relativo prescrito en una sola puntuación. Para cada ensayo,
donde represents representa el tiempo intermedio para el segmento » i » y target representa el tiempo de movimiento de la meta para cada segmento de la tarea (es decir, 300 ms).
Debido a que los datos no se distribuyeron normalmente (RMSE y los datos de tiempo están sesgados positivamente), cada variable dependiente sufrió una transformación logarítmica (ln). Los datos transformados para cada variable dependiente se sometieron de forma independiente a un ANOVA que contrastaba tres grupos (C, FW y FB) × tres fases (prueba previa, retención de 10 minutos, retención de 24 horas) × cuatro bloques de ensayos (1-5, 6-10, 11-15 y 16-20), con medidas repetidas en los dos últimos factores. Todos los efectos principales significativos y los efectos principales simples que involucran más de dos medios se desglosaron utilizando el ajuste de Bonferroni. Para todas las comparaciones, un efecto se consideró significativo si p < 0,05. El cuadrado eta parcial (np2) es el tamaño del efecto reportado para todos los efectos significativos (Cohen, 1988).
Resultados
Tiempo de movimiento total
El ANOVA calculado en |CE| (Figura 2, panel superior) reveló efectos principales significativos para el grupo de variables, F(2, 87) = 5.04, p = 0.08, np2 = 0.10, y fase, F(2, 174) = 5.16, p = 0.007, np2 = 0.06, como así como una interacción significativa de fase × grupo, F(4, 174) = 4,93, p = 0,001, np2 = 0,10. El desglose de esta interacción no reveló ninguna diferencia de grupo significativa en la prueba previa (F < 1). En la prueba de retención de 10 minutos, F(2, 87) = 10,12, p < 0,001, np2 = 0,19, las comparaciones post hoc revelaron que el grupo de control tenía un | CE| significativamente mayor que los grupos FW y FB (p < 0,05 en ambos casos), que no diferían significativamente entre sí (p = 0,19). En la prueba de retención de 24 horas, F(2, 87) = 4,34, p = 0,016, np2 = 0,09, el grupo FW tuvo un |CE| significativamente menor que el grupo control (p = 0,012)1.FIGURA
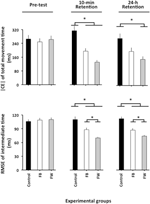
Gráfico 2 Error constante absoluto de TMT y error cuadrático medio de raíz del tiempo relativo en función de las fases experimentales y los grupos experimentales (Experimento 1). * p < 0,05. Las barras de error indican el error estándar de la media.
La ANOVA calculada en VE(no mostrada) reveló efectos principales significativos para la variable fase, F(2, 174) = 13,12, p < 0,001, np2 = 0,13, y bloque, F (3, 261) = 48,79, p < 0,001, np2 = 0,36. Las comparaciones post-hoc del efecto de fase revelaron un mayor VE de tiempo total en la prueba previa que en las pruebas de retención de 10 minutos y 24 horas (p < 0.002 en ambos casos), que no diferían significativamente entre sí (p = 0,68). El efecto principal del bloque resultó de una VE significativamente mayor de tiempo total para el primero que para los tres bloques restantes de ensayos (p < 0,001 en todos los casos), que no difirieron significativamente entre sí (p>0,05 en todos los casos).
Tiempo relativo
El ANOVA calculado sobre la RMSE de tiempo relativo reveló efectos principales significativos para el grupo de variables, F(2, 87) = 21,49, p < 0,001, np2 = 0,33, fase, F(2, 174) = 39,98, p < 0,001, np2 = 0.31 y bloque, F(3, 261) = 14.77, p < 0.001, np2 = 0.14, así como una importante fase × interacción de grupo, F(4, 174) = 12.81, p < 0.001, np2 = 0.23. El efecto principal del bloque resultó de un RMSE de tiempo relativo significativamente mayor para el primero que para los tres bloques restantes de ensayos (p < 0,001 en todos los casos), que no difirieron significativamente entre sí (p>0,3 en todos los casos). Más interesante, el desglose de la interacción fase × grupo (Figura 2, panel inferior) no reveló ninguna diferencia significativa de grupo en la prueba previa (F < 1). En las pruebas de retención de 10 minutos, F(2, 87) = 14,85, p < 0,001, np2 = 0,34, y en las pruebas de retención de 24 horas, F(2, 87) = 23,23, p < 0,001, np2 = 0,35, aunque el grupo FB superó significativamente al grupo control (p = 0,001 en ambos casos), el grupo FB, a su vez, superó significativamente al grupo Grupo FW (p = 0,001 y p = 0,02, respectivamente)2.
Discusión
El presente experimento fue diseñado para ampliar nuestro conocimiento de las condiciones de observación que optimizan el aprendizaje de un nuevo patrón de tiempo relativo. En esta situación de aprendizaje, se proporcionaron KR a dos grupos de observación, que observaron una variedad de demostraciones, antes o después de cada ensayo durante la fase de adquisición. En concreto, queríamos evaluar si se mejoraría el aprendizaje cuando los alumnos conocieran la «calidad» o las características de una demostración antes de observarla. Los resultados son sencillos.
En primer lugar, como se ilustra en la Figura 2, los grupos FW y FB superaron al grupo control en las pruebas de retención. Esto fue cierto para el aprendizaje tanto del TMT como del tiempo relativo. Este resultado esperado confirma hallazgos previos que indicaban que la observación permite aprender una nueva habilidad motora(ver McCullagh et al., 1989; Hodges et al., 2007; Vogt y Thomaschke, 2007; Ste-Marie et al., 2012; Lago-Rodríguez et al., 2014, para revisiones sobre el aprendizaje observacional) y, en particular, un nuevo patrón de tiempo relativo (Rohbanfard y Proteau, 2011; Andrieux y Proteau, 2013, 2014).
El hallazgo más importante del presente estudio es que el grupo de FB tuvo un mejor desempeño que el grupo de FW en las pruebas de retención. Aunque los dos grupos observaron las mismas demostraciones, los resultados revelaron que el aprendizaje se optimiza cuando se le da un conocimiento previo de la calidad o las características de la demostración presenciada. Este hallazgo encaja bien con informes anteriores de nuestro laboratorio (Rohbanfard y Proteau, 2011; Andrieux y Proteau, 2013) que muestran que un régimen de observación mixto, en el que los observadores saben quién es el modelo experto y quién es el modelo novato, favorece el aprendizaje de un nuevo patrón de tiempo relativo mejor que la observación solo por expertos o principiantes.
Tener conocimiento previo de que se mostrará una demostración menos que perfecta puede ser crítico, considerando que se ha reportado que los participantes novatos, como en el presente estudio, no son buenos para evaluar la calidad de una demostración. Por ejemplo, Aglioti et al. (2008) hicieron que jugadores de baloncesto novatos y expertos observaran videoclips que mostraban tiros de tiro libre, y los videoclips se detuvieron en diferentes momentos antes o inmediatamente después del lanzamiento de la pelota. Los jugadores de baloncesto expertos y entrenadores / periodistas especializados fueron mejores y más rápidos en predecir el destino del tiro (exitoso o no) que los novatos (para resultados similares, ver también Wright et al., 2010; Abreu et al., 2012; Tomeo et al., 2013; Balser et al., 2014; Candidi et al., 2014; Renden et al., 2014).
La ventaja del protocolo FW sobre el FB es importante y, hasta donde sabemos, un hallazgo similar no se ha reportado hasta ahora. Por lo tanto, una réplica de este hallazgo parecía importante. Además, nos preguntamos si la ventaja observada para el protocolo FW se produjo solo después de una cantidad limitada de observación. Por último, teníamos curiosidad por ver si alternar el protocolo FW y el FB daría lugar a efectos aditivos. Realizamos el experimento 2 para abordar estas preguntas.
Experimento 2
Métodos
Participantes
Los 60 participantes que se ofrecieron como voluntarios para este experimento procedían de la misma población que la del Experimento 1 (36 hombres y 24 mujeres; edad media = 22,7 años; DE = 4,9 años). Los participantes eran ingenuos con respecto al propósito de este estudio y no tenían experiencia previa con la tarea. Completaron y firmaron formularios de consentimiento individual antes de participar. El Comité de Ética en Investigación en Ciencias de la Salud de la Universidad de Montreal aprobó este experimento.
Aparato, Tarea, Fases Experimentales, Procedimiento y Análisis de Datos
Utilizamos la misma tarea, aparato y procedimientos que en el Experimento 1. La principal diferencia entre el presente experimento y el Experimento 1 es que los participantes realizaron dos sesiones de adquisición, que condujeron a un total de cinco fases experimentales: prueba previa, adquisición 1, prueba de retención inmediata, adquisición 2 y prueba de retención de 24 horas.
Los participantes se asignaron aleatoriamente a uno de los tres grupos, cada uno de ellos compuesto por 20 participantes (8 mujeres por grupo): KR de retroalimentación y observación durante la adquisición 1 y 2 (FW1-2); observación de retroalimentación y KR durante la adquisición 1, pero observación y retroalimentación KR durante la adquisición 2 (FW/FB); y observación y retroalimentación de KR durante la adquisición 1 y 2 (FB1-2). Usamos el mismo video y modelos que en el experimento 1; sin embargo, el orden de presentación del video fue diferente en la adquisición 2 de la adquisición 1. También se informó a todos los participantes de que realizarían la misma tarea después de cada fase de adquisición, pero sin tener en cuenta su propio rendimiento.
Utilizamos las mismas variables dependientes y transformación de datos que en el experimento 1. Para cada variable dependiente, se realizó un ANOVA bidireccional contrastando los tres grupos (FW1-2, FW/FB y FB1-2) × tres fases experimentales (prueba previa, retención inmediata y retención de 24 horas). Todos los efectos principales significativos y los efectos principales simples que involucran más de dos medios se desglosaron utilizando el ajuste de Bonferroni. Para todas las comparaciones, un efecto se consideró significativo si p < 0,05. El cuadrado eta parcial (np2) es el tamaño del efecto reportado para todos los efectos significativos (Cohen, 1988).
Resultados
Tiempo de Movimiento total
El ANOVA calculado para el |CE| del tiempo de movimiento (Figura 3) reveló efectos principales significativos para el grupo de variables, F(2, 57) = 8.13, p = 0.001, np2 = 0.22, y fase, F(2, 114) = 21.13, p < 0.001, np2 = 0,27, así como una interacción significativa de grupo × fase, F(4, 114) = 2,57, p = 0,042, np2 = 0,08. El desglose de esta interacción no reveló ninguna diferencia de grupo significativa en la prueba previa (F < 1). En la prueba de retención inmediata, F (2, 57) = 10,27, p < 0,002, np2 = 0.27, el grupo FB1-2 tuvo un | CE| significativamente mayor que los grupos FW1-2 y FW/FB (p < 0,001 en ambos casos), que no difirieron significativamente entre sí (p>0,20). En la prueba de retención de 24 horas, F (2, 57) = 3,19, p = 0,049, np2 = 0,10, el grupo FW1-2 tuvo un |CE| ligeramente menor que el grupo FB1-2 (p = 0,079) 3.FIGURA
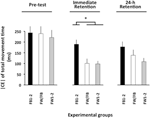
Gráfico 3 Error constante absoluto de TMT en función de las fases experimentales y los grupos experimentales (Experimento 2). * p < 0,05. Las barras de error indican el error estándar de la media.
La ANOVA calculada en VE (no mostrada) reveló efectos principales significativos para el grupo de variables, F(2, 57) = 7,82, p = 0,001, np2 = 0,21, y fase, F(2, 114) = 21,10, p < 0,001, np2 = 0,27, así como una interacción significativa de grupo × fase, F(4, 114) = 4,38, p = 0,002, np2 = 0,13. El desglose de esta interacción no reveló ninguna diferencia de grupo significativa en la prueba previa (F < 1) y en la prueba de retención de 24 horas, F(2, 57) = 1,26, p>0,20. En la prueba de retención inmediata, F (2, 57) = 10,26, p < 0,002, np2 = 0,27, el grupo FB1-2 (62.7 ms) tuvieron una VE significativamente mayor que los grupos FW1-2 (51,1 ms) y FW/FB (53,4 ms) (p < 0,001 en ambos casos), que no diferían significativamente entre sí (p>0,20)4.
Tiempo relativo
El ANOVA calculado para la RMSE de tiempo relativo reveló efectos principales significativos para el grupo de variables, F(2, 57) = 4,86, p = 0,01, np2 = 0,15, y fase, F(2, 114) = 78,21, p < 0,001, np2 = 0,58. Hubo un RMSE de tiempo relativo significativamente mayor en la prueba previa que en la prueba de retención inmediata y en la prueba de retención de 24 horas (p < 0.001 en ambos casos; ver Figura 4, panel derecho), que no diferían significativamente entre sí (p>0,20). Finalmente, los grupos FW1-2 y FW/FB superaron al grupo FB1-2 (p = 0,01 y p = 0,07; ver Figura 4, panel izquierdo), pero no se diferenciaron significativamente entre sí (p>0,20).FIGURA
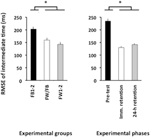
Gráfico 4 Error cuadrático medio de raíz del tiempo relativo (Experimento 2) en función de los grupos experimentales (panel izquierdo) y las fases experimentales (panel derecho). * p < 0,05. Las barras de error indican el error estándar de la media.
Discusión
Como se esperaba, la disminución del error observada al pasar de la prueba previa a las pruebas de retención respalda los hallazgos previos que indican que la observación ayuda al aprendizaje de un nuevo patrón de tiempo relativo (Blandin et al., 1999; Rohbanfard y Proteau, 2011; Andrieux y Proteau, 2013, 2014). Más importante aún, los resultados del Experimento 2 replicaron los del Experimento 1, en el sentido de que el grupo FW1-2 superó al grupo FB1-2. Por lo tanto, se puede concluir con seguridad que aprender a cambiar el patrón de tiempo relativo que emerge naturalmente de las restricciones de la tarea a un nuevo tiempo relativo impuesto a través de la observación se favorece cuando se informa del rendimiento del modelo antes de la observación en lugar de después. Finalmente, los resultados también mostraron que lo que se ha aprendido en un protocolo FB no se suma a lo que se puede aprender en un protocolo FW.
Discusión general
El objetivo principal del presente estudio fue determinar cuándo en un protocolo de observación debe proporcionarse el KR relativo al desempeño del modelo, es decir, antes o después de cada demostración. Los resultados de los dos experimentos del presente estudio indicaron claramente que estar informado del desempeño del modelo antes de cada demostración favoreció el aprendizaje de un nuevo patrón de tiempo relativo mejor que cuando el observador fue informado del desempeño del modelo después de cada demostración. Además, los resultados del experimento 2 sugieren que la ventaja del protocolo FW sobre el FB siguió siendo significativa incluso cuando se duplicó el número de ensayos de observación. Respecto a este último punto, no sostenemos que un FW protocolo debe ser favorecida en todos los casos y con todos los niveles de experiencia de los observadores. Más bien, subrayamos que el efecto es confiable cuando se consideran observadores novatos.
Nuestros resultados pueden indicar que un protocolo de observación feedforward prepara al observador para participar específicamente en procesos de imitación cuando se muestra un rendimiento experto o avanzado o en procesos de detección de errores cuando se presenta un rendimiento principiante o novato. Esta idea encaja bien con trabajos anteriores de Decety et al. (1997), que afirmaba que los patrones de activación cerebral durante la observación de la acción dependen tanto de la naturaleza del procesamiento ejecutivo requerido como de las propiedades extrínsecas de la acción presentada. Específicamente, estos autores demostraron que diferentes áreas del cerebro se vuelven más activas cuando se observa para reconocer, lo que podría ser el caso cuando se observa un modelo novato o un desempeño pobre o intermedio, y cuando se observa para imitar, lo que probablemente sea el caso cuando se observa un modelo experto.
Una explicación alternativa de nuestros hallazgos podría ser que un protocolo de FW resulta en una «desactivación» del AON cuando se informó explícitamente a los participantes de que seguiría una demostración deficiente. Por ejemplo, en una tarea de elevación de objetos, se ha demostrado que la modulación del potencial evocado motor (MEP) por estimulación magnética transcraneal (TMS) durante la observación de la acción de elevación se escala a la fuerza requerida para realizar la acción de agarre y elevación (Alaerts et al., 2010a). También se demostró que cuando las señales visuales sugerían que el objeto era más pesado de lo que realmente era, la modulación del MEP dependía principalmente del perfil cinemático observado en lugar del peso aparente del objeto (Alaerts et al., 2010b; Senot et al., 2011). Sin embargo, en un estudio de Senot et al. (2011), se proporcionó información falsa y explícita sobre el peso del objeto en una condición experimental. Esto resultó en un conflicto entre el perfil cinemático esperado dado el peso anunciado y el perfil cinemático real de la acción de agarre y elevación, lo que llevó a una «inhibición general del sistema corticoespinal».»Dicho de otra manera, al menos una parte del AON había sido apagada. Por lo tanto, podría ser que los participantes en nuestro estudio apagaran la AON cuando se esperaba un rendimiento deficiente del modelo, dejando la AON activa solo para ensayos buenos.
Esta propuesta es difícil de conciliar, sin embargo, con informes recientes de nuestro laboratorio que muestran que la observación de un modelo experto y un modelo novato resultó en un mejor aprendizaje de un nuevo patrón de tiempo relativo que la observación de un modelo novato o un modelo experto solo. Si uno pudiera apagar el AON cuando se le informa de que se mostrará una demostración deficiente (es decir, un modelo novato), entonces el aprendizaje del grupo de observación mixto habría coincidido y no superado al del grupo de observación de expertos. Más bien, volviendo a nuestra primera propuesta, sugerimos que un protocolo FW ayuda a los intérpretes novatos a detectar y cuantificar errores en el rendimiento del modelo, algo que generalmente hacen mal (Aglioti et al., 2008; Wright et al., 2010; Abreu et al., 2012; Tomeo et al., 2013; Balser et al., 2014; Candidi et al., 2014; Renden et al., 2014). A su vez, la mejor detección y cuantificación del rendimiento del modelo puede favorecer el desarrollo de modelos inversos (Jordan, 1996) y avanzados (Wolpert y Miall, 1996) de control motor.
En conclusión, la observación es una poderosa herramienta de aprendizaje que está disponible para cualquier persona y requiere solo un equipo mínimo para ser utilizado. Ahora está bien demostrado que los beneficios de la observación para modificar el tiempo relativo (es decir, el tempo) de la habilidad motora se mejoran cuando uno tiene acceso a una variedad de actuaciones que van desde principiantes hasta expertos, ya sea a través de horarios de observación variables o mixtos. Los resultados del presente estudio sugieren que esos beneficios se optimizan si el observador conoce de antemano la calidad del desempeño que está a punto de observar durante la primera sesión de observación. Esto podría ser muy importante en un contexto de clase en el que un maestro/entrenador usaría un protocolo de observación por video. Por ejemplo, si la intención del observador es aprender un aspecto específico de un swing de golf, es probable que el resultado del swing (es decir, el vuelo de la pelota) no se muestre en el video. Por lo tanto, el observador no sería capaz de «adivinar» la experiencia del modelo a partir del resultado del swing y, como hemos demostrado en el presente estudio, aprender mejor si se le informó con anticipación de la calidad de lo que está a punto de observar.
Contribuciones de los autores
Todos los autores enumerados, han hecho una contribución sustancial, directa e intelectual al trabajo, y lo aprobaron para su publicación.
Financiación
Este trabajo fue apoyado por una Beca de Descubrimiento (LP) proporcionada por el Consejo de Investigación de Ciencias Naturales e Ingeniería de Canadá (subvención no. 111280-2013).
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un conflicto de intereses potencial.
Notas a pie de página
1. ^Para determinar que las diferencias observadas en las dos pruebas de retención entre el grupo control y los grupos FW y FB resultaron de una disminución significativa en el |CE| del tiempo total de movimiento, en un análisis complementario descompusimos la interacción de grupo × fase reportada en el texto principal mediante el cálculo de un ANOVA separado para cada grupo. Los resultados revelaron que para los grupos control y FB, el |CE| del tiempo total de movimiento no difirió significativamente entre las fases, , respectivamente. Por el contrario, para los grupos FW, hubo un efecto principal significativo de las fases, F(2, 86) = 11.60, p < 0,01, np2 = 0,1, que reveló una disminución significativa en el / CE / del tiempo de movimiento total desde la prueba previa a las dos pruebas de retención (p < 0,01), que no difirieron significativamente entre sí (p>0,10).
2. ^Al igual que hicimos para el |CE| del tiempo de movimiento total, en un análisis complementario descompusimos la interacción de grupo × fase reportada en el texto principal para el RMSE del tiempo relativo computando un ANOVA separado para cada grupo. Los resultados revelaron que para el grupo de control, la RMSE del tiempo relativo no difería significativamente entre las fases, F(2, 86) = 0,32, p = 0,72, np2=0,01. Por el contrario, tanto para los grupos FB como FW, hubo un efecto principal significativo de las fases que revelaron una disminución significativa en el RMSE del tiempo relativo que va desde la prueba previa a las dos pruebas de retención (p < 0.01), que no difirieron significativamente entre sí (p > 0.10).
3. ^Como hicimos en el experimento 1, en un análisis complementario descompusimos la interacción de grupo × fase reportada en el texto principal computando un ANOVA separado para cada grupo. Los resultados revelaron que para el grupo FB1-2, el / CE / del tiempo total de movimiento no difirió significativamente entre las fases, F(2, 56) < 1, p = 0,45, np2 = 0,03. Por el contrario, para los grupos FW1-2 y FW-FB, hubo un efecto principal significativo de las fases, que, para ambos grupos, reveló una disminución significativa en el |CE| del tiempo de movimiento total desde la prueba previa a las dos pruebas de retención (p < 0.01), que no diferían significativamente entre sí (p>0,10).
4. ^Para el VE del tiempo de movimiento total, el desglose de la interacción de grupo × fase reveló un efecto principal significativo de las fases para los tres grupos . Para los grupos FW1-2 y FB1-2, las comparaciones pos-hoc revelaron una VE significativamente mayor en la prueba previa que en ambas pruebas de retención (p < 0,01), que no diferían significativamente entre sí (p>0,30). Para el grupo FW-FB, el VE del tiempo de movimiento total fue significativamente mayor en la prueba previa que en la prueba de retención de 24 horas (p < 0,01).
Abreu, A. M., Macaluso, E., y Azevedo, R. T. (2012). Anticipación de la acción más allá de la red de observación de la acción: un estudio funcional de imágenes por resonancia magnética en jugadores de baloncesto expertos. EUR. J. Neurocirujano. 35, 1646–1654. doi: 10.1111 / j. 1460-9568. 2012. 08104.x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Aglioti, S. M., Cesari, P., Romani, M., and Urgesi, C. (2008). Anticipación de la acción y resonancia motora en jugadores de baloncesto de élite. NAT. Neurociencia. 11, 1109–1116. doi: 10.1038 / nn.2182
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Al-Abood, S.A., Davids, K. F. y Bennett, S. J. (2001). Especificidad de las limitaciones de las tareas y efectos de las demostraciones visuales y las instrucciones verbales en la dirección de la búsqueda de los alumnos durante la adquisición de habilidades. J. Mot. Behav. 33, 295–305. doi: 10.1080/00222890109601915
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Alaerts, K., Senot, P., Swinnen, S. P., Craighero, L., Wenderoth, N., and Fadiga, L. (2010a). Los requisitos de fuerza de elevación de objetos observados están codificados por el sistema motor del observador: un estudio TMS. EUR. J. Neurocirujano. 31, 1144–1153. doi: 10.1111 / j. 1460-9568. 2010. 07124.x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Alaerts, K., Swinnen, S. P., and Wenderoth, N. (2010b). Observando cómo otros levantan objetos ligeros o pesados: ¿qué señales visuales median en la codificación de la fuerza muscular en la corteza motora primaria? Neuropsicología 48, 2082-2090. doi: 10.1016 / j. neuropsicología.2010.03.029
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Andrieux, M., y Proteau, L. (2013). Observación aprendizaje de una tarea motora: ¿quién y cuándo? Exp. Brain Res. 229, 125-137. doi: 10.1007 / s00221-013-3598-x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Andrieux, M., y Proteau, L. (2014). La observación mixta favorece el aprendizaje motor a través de una mejor estimación del rendimiento del modelo. Exp. Brain Res. 232, 3121-3132. doi: 10.1007 / s00221-014-4000-3
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Badets, A., and Blandin, Y. (2004). El papel del conocimiento de la frecuencia de los resultados en el aprendizaje a través de la observación. J. Mot. Behav. 36, 62–70. doi: 10.3200 / JMBR.36.1.62-70
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Badets, A., and Blandin, Y. (2005). Aprendizaje observacional: efectos del conocimiento del ancho de banda de los resultados. J. Mot. Behav. 37, 211–216. doi: 10.3200 / JMBR.37.3.211-216
PubMed Abstract | CrossRef Full Text | Google Scholar
Badets, A., Blandin, Y., Wright, D. L., and Shea, C. H. (2006). Error detection processes during observational learning. Res. Q. Exerc. Sport 77, 177–184. doi: 10.1080/02701367.2006.10599352
PubMed Abstract | CrossRef Full Text | Google Scholar
Balser, N., Lorey, B., Pilgramm, S., Naumann, T., Kindermann, S., Stark, R., et al. (2014). La influencia de la experiencia en la activación cerebral de la red de observación de acción durante la anticipación del tenis y el voleibol sirve. Delantero. Zumbido. Neurociencia. 8:568. doi: 10.3389 / fnhum.2014.00568
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Bird, G., y Heyes, C. (2005). Aprendizaje dependiente del efector mediante la observación de una secuencia de movimiento de los dedos. J. Exp. Psicol. Zumbido. Percepto. Realizar. 31, 262–275. doi: 10.1037/0096-1523.31.2.262
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Black, C. B., and Wright, D. L. (2000). ¿Puede la práctica observacional facilitar el reconocimiento de errores y la producción de movimiento? Re. P. Ejercicio. Sport 71, 331-339. doi: 10.1080/02701367.2000.10608916
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Blandin, Y. (1994). Procesos Cognitivos Involucrados Durante El Aprendizaje de Tareas de Sincronización Espacio-Temporal Bajo Diferentes Condiciones De Práctica y Observación De Una Materia Modelo, Tesis Doctoral Inédita. , Universidad de Montreal.
Blandin, Y., Lhuisset, L., and Proteau, L. (1999). Procesos cognitivos subyacentes al aprendizaje observacional de las habilidades motoras. Q. J. Exp. Psicol. 52, 957–979. doi: 10.1080/713755856
Texto completo de CrossRef | Google Scholar
Blandin, Y., Proteau, L., y Alain, C. (1994). Sobre los procesos cognitivos subyacentes a la interferencia contextual y el aprendizaje observacional. J. Mot. Behav. 26, 18–26. doi: 10.1080/00222895.1994.9941657
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Buccino, G., Binkofski, F., Fink, G. R., Fadiga, L., Fogassi, L., Gallese, V., et al. (2001). La observación de acción activa las áreas premotoras y parietales de manera somatotópica: un estudio de IRMF. EUR. J. Neurocirujano. 13, 400–404. doi: 10.1046 / j. 1460-9568. 2001. 01385.x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Buchanan, J. J., and Dean, N. J. (2010). La especificidad en la práctica beneficia el aprendizaje en modelos novatos y la variabilidad en la demostración beneficia la práctica observacional. Psicol. Res. 74, 313 a 326. doi: 10.1007 / s00426-009-0254-y
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Buchanan, J. J., Ryu, Y. U., Zihlman, K., and Wright, D. L. (2008). Práctica observacional de características de movimiento relativas pero no absolutas en una tarea de coordinación multi-conjunta de una sola extremidad. Exp. Brain Res. 191, 157-169. doi: 10.1007 / s00221-008-1512-8
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Candidi, M., Sacheli, L. M., Mega, I., y Aglioti, S. M. (2014). Mapeo somatotópico de errores de digitación de piano en expertos sensomotores: estudios de TMS en pianistas y ingenuos musicalmente entrenados visualmente. Cereb. Cortex 24, 435-443. doi: 10.1093/cercor / bhs325
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
Carroll, W. R., y Bandura, A. (1990). Guía de representación de la producción de acción en el aprendizaje observacional: un análisis causal. J. Mot. Behav. 22, 85–97. doi: 10.1080/00222895.1990.10735503
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Cisek, P., y Kalaska, J. F. (2004). Correlatos neuronales del ensayo mental en la corteza premotora dorsal. Nature 431, 993-996. doi: 10.1038 / nature03005
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
Cohen, J. (1988). Análisis de Poder Estadístico para las Ciencias del Comportamiento. Hillsdale, NJ: Lawrence Erlbaum.
Google Scholar
Collier, G. L., y Wright, C. E. (1995). Reajuste temporal de muestras y raciones complejas en golpeteo rítmico. J. Exp. Psicol. Zumbido. Percepto. Realizar. 21, 602–627. doi: 10.1037/0096-1523.21.3.602
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Cross, E. S., Kraemer, D. J. M., Hamilton, A. F. D., Kelley, W. M., and Grafton, S. T. (2009). Sensibilidad de la red de observación de la acción al aprendizaje físico y observacional. Cereb. Corteza 19, 315-326. doi: 10.1093/cercor / bhn083
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
Decety, J., Grèzes, J., Costes, N., Perani, D., Jeannerod, M., Procyk, E., et al. (1997). Actividad cerebral durante la observación de acciones: influencia del contenido de la acción y la estrategia del sujeto. Cerebro 120, 1763-1777. doi: 10.1093/cerebro/120.10.1763
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Dushanova, J., y Donoghue, J. (2010). Las neuronas de la corteza motora primaria participan durante la observación de la acción. EUR. J. Neurocirujano. 31, 386–398. doi: 10.1111 / j. 1460-9568. 2009. 07067.x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Frey, S. H., and Gerry, V. E. (2006). Modulación de la actividad neuronal durante el aprendizaje observacional de las acciones y sus órdenes secuenciales. J. Neurocirujano. 26, 13194–13201. doi: 10.1523 / JNEUROSCI.3914-06.2006
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Gallese V., Fadiga L., Fogassi L., Rizzolatti G. (2002). «Action representation and the inferior parietal lobule», en Common Mechanisms in Perception and Action: Attention and Performance, Vol. XIX, editores, W. Prinz y B. Hommel (Oxford: Oxford University Press), 247 a 266.
Grafton, S. T., Fadiga, L., Arbib, M. A., and Rizzolatti, G. (1997). Activación de la corteza promotora durante la observación y el nombramiento de herramientas familiares. Neuroimagen 6, 231-236. doi: 10.1006 / nimg.1997.0293
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Hayes, S. J., Elliott, D., and Bennett, S. J. (2010). Las representaciones motoras generales se desarrollan durante la acción-observación. Exp. Brain Res. 204, 199-206. doi: 10.1007 / s00221-010-2303-6
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Heyes, C. M., y Foster, C. L. (2002). Aprendizaje motor por observación: evidencia de una tarea de tiempo de reacción en serie. Q. J. Exp. Psicol. 55, 593–607. doi: 10.1080/02724980143000389
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
Hodges, N. J., Chua, R., and Franks, I. M. (2003). El papel del vídeo en la facilitación de la percepción y la acción de un movimiento de coordinación novedoso. J. Mot. Behav. 35, 247–260. doi: 10.1080/00222890309602138
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Hodges, N. J., Williams, A. M., Hayes, S. J., and Breslin, G. (2007). ¿Qué se modela durante el aprendizaje observacional? J. Sports Sci. 25, 531–545. doi: 10.1080/02640410600946860
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
Jordan, M. I. (1996). «Computational aspects of motor control and motor learning,» in Handbook of Perception and Action: Vol. 2, Motion Skills, eds H. Heuer y S. W. Keele (Nueva York, NY: Academic Press), págs. 71 a 120.
Kilner, J. M., Neal, A., Weiskopf, N., Friston, K. J., and Frith, C. D. (2009). Evidencia de neuronas espejo en giro frontal inferior humano. J. Neurocirujano. 29, 10153–10159. doi: 10.1523 / JNEUROSCI.2668-09.2009
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Lago-Rodríguez, A., Cheeran, B., y Koch, G. (2014). The role of mirror neurons in observational motor learning: an integrative review (en inglés). EUR. J. Movimiento Humano. 32, 82–103.
Lee, T. D., Swinnen, S. P., and Serrien, D. J. (1994). Esfuerzo cognitivo y aprendizaje motor. Quest 46, 328-344. doi: 10.1080/00336297.1994.10484130
Texto completo de CrossRef | Google Scholar
Lee, T. D., and White, M. A. (1990). Influencia de un horario de práctica de modelos no calificados en el aprendizaje motor observacional. Zumbido. Mov. Sci. 9, 349–367. doi: 10.1016/0167-9457(90)90008-2
Texto completo de CrossRef | Google Scholar
Martens, R., Burwitz, L., and Zuckerman, J. (1976). Modelado de efectos sobre el rendimiento del motor. Res. Q. 47, 277-291.
Resumen de PubMed | Google Scholar
McCullagh, P., y Caird, J. K. (1990). Modelos correctos y de aprendizaje y el uso del conocimiento de modelos de resultados en la adquisición y retención de una habilidad motora. J. Movimiento Humano. Perno. 18, 107–116.
McCullagh, P., y Meyer, K. N. (1997). Aprendizaje versus modelos correctos: influencia del tipo de modelo en el aprendizaje de un levantamiento de sentadillas con peso libre. Res. Q. Exerc. Sport 68, 56-61. doi: 10.1080/02701367.1997.10608866
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
McCullagh, P., Weiss, M. R., and Ross, D. (1989). Modeling considerations in motor skill acquisition and performance: an integrated approach (en inglés). Exerc. Ciencias del Deporte. Apo. 17, 475-513.
Resumen de PubMed | Google Scholar
Oosterhof, N. N., Wiggett, A. J., Diedrichsen, J., Tipper, S. P., and Downing, P. E. (2010). El mapeo de información basado en la superficie revela representaciones de acción de visión transversal en la corteza parietal y occipitotemporal humana. J. Neurofisiol. 104, 1077–1089. doi: 10.1152 / jn.00326.2010
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Pollock, B. J., and Lee, T. D. (1992). Efectos del nivel de habilidad del modelo en el aprendizaje motor observacional. Res. Q. Exerc. Sport 63, 25-29. doi: 10.1080/02701367.1992.10607553
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Renden, P. G., Kerstens, S., Oudejans, R. R. D., and Cañal-Bruland, R. (2014). Falta o buceo? Contribuciones motoras para juzgar situaciones de falta ambiguas en el fútbol. EUR. J. Sport Sci. 14(Supl. 1), S221–S227. doi: 10.1080/17461391.2012.683813
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Rizzolatti, G., Cattaneo, L., Fabbri-Destro, M., and Rozzi, S. (2014). Mecanismos corticales subyacentes a la organización de acciones dirigidas a objetivos y comprensión de acciones basadas en neuronas espejo. Fisiol. Apo. 94, 655-706. doi: 10.1152 / physrev.00009.2013
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Rizzolatti, G., y Fogassi, L. (2014). The mirror mechanism: recent findings and perspectives (en inglés). Philos. Trans. R. Soc. Lond. Ser. B Biol. Sci. 369:20130420. doi: 10.1098 / rstb.2013.0420
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Rohbanfard, H., y Proteau, L. (2011). Aprendizaje a través de la observación: una combinación de modelos expertos y novatos favorece el aprendizaje. Exp. Brain Res. 215, 183-197. doi: 10.1007 / s00221-011-2882-x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Senot, P., D’Ausilio, A., Franca, M., Caselli, L., Craighero, L., and Fadiga, L. (2011). Efecto de las etiquetas relacionadas con el peso sobre la excitabilidad corticoespinal durante la observación del agarre: un estudio de TMS. Exp. Brain Res. 211, 161-167. doi: 10.1007 / s00221-011-2635-x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Ste-Marie, D. M., Law, B., Rymal, A. M., Jenny, O., Hall, C., and McCullagh, P. (2012). Intervenciones de observación para el aprendizaje de habilidades motoras y el desempeño: un modelo aplicado para el uso de la observación. Int. Apo. Deporte Exerc. Psicol. 5, 145–176. doi: 10.1080 / 1750984X.2012.665076
Texto completo de CrossRef | Google Scholar
Tomeo, E., Cesari, P., Aglioti, S. M., and Urgesi, C. (2013). Engañar a los pateadores pero no a los porteros: correlatos conductuales y neurofisiológicos de la detección de acciones falsas en el fútbol. Cereb. Cortex 23, 2765-2778. doi: 10.1093/cercor / bhs279
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
Vogt, S., y Thomaschke, R. (2007). From visuo-motor interactions to imitation learning: behavioural and brain imaging studies (en inglés). J. Sports Sci. 25, 497–517. doi: 10.1080/02640410600946779
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Wolpert, D. M., y Miall, R. C. (1996). Modelos delanteros para control fisiológico del motor. Red Neuronal. 9, 1265–1279. doi: 10.1016 / S0893-6080(96)00035-4
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Wright, D. L., Li, Y., y Coady, W. (1997). Procesos cognitivos relacionados con la interferencia contextual y el aprendizaje observacional: una réplica de Blandin, Proteau y Alain (1994). Res. Q. Exerc. Sport 68, 106-109. doi: 10.1080/02701367.1997.10608872
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Wright, M. J., Bishop, D. T., Jackson, R. C., and Abernethy, B. (2010). Functional MRI reveals expert-novice differences during sport-related anticipation. Neuroreport 21, 94–98. doi: 10.1097/WNR.0b013e328333dff2
PubMed Abstract | CrossRef Full Text | Google Scholar