the Technical Details: Chemistry
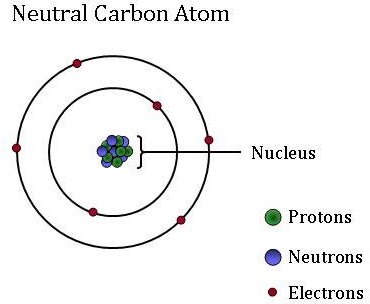
atomit, jotka ovat kaiken aineen perusyksikkö, voivat poiketa suuresti toisistaan. Vaikka atomit ovat liian pieniä nähdäkseen ilman suuritehoisia mikroskooppeja, ne koostuvat vielä pienemmistä hiukkasista: protoneista, neutroneista ja elektroneista.
elektronit, jotka ovat erittäin kevyitä, negatiivisesti varautuneita hiukkasia, kiertävät keskusmassaa-atomin ydintä. Atomit voivat saada tai menettää elektroneja, jotka muuttavat atomin varausta (jolloin syntyy ioneja). Atomi pysyy kuitenkin samana alkuaineena riippumatta siitä, onko sillä positiivinen, negatiivinen vai neutraali varaus.
atomin pieni, tiheä ydin (tai keskus) sisältää muut komponentit–protonit ja neutronit. Protonit ovat positiivisesti varautuneita hiukkasia, ja protonien lukumäärä on aina kiinteä tietylle alkuaineelle. Toisin sanoen protonien määrä antaa jokaiselle alkuaineelle sen ainutlaatuisen, yksilöllisen identiteetin. Esimerkiksi hiiliatomissa on kuusi protonia, mutta atomi, jossa on vain viisi protonia, on boori, kun taas atomi, jossa on seitsemän protonia, on alkuaine typpi.
neutronit ovat neutraaleja-niillä ei ole varausta. Isotoopit ovat saman alkuaineen atomeja, joilla on eri määrä neutroneja. Vaikka saman alkuaineen isotoopit ovat reaktiivisuuden suhteen kaksosia, neutronien eri määrä tarkoittaa, että niillä on eri massa. Jotkin isotoopit ovat joissakin materiaaleissa runsaampia kuin toiset, koska jotkin Fysikaaliset ja kemialliset prosessit ”suosivat” yhtä isotooppia toisen sijaan. Näitä isotooppipitoisuuseroja käytetään ”merkintöinä” ilmakehän HIILIDIOKSIDINÄYTTEESTÄ löytyvien eri hiilidioksidilähteiden tunnistamiseksi. NOAA: n ilmakehätutkijat käyttävät näitä isotooppimerkintöjä määrittääkseen, mikä prosenttiosuus hiilestä oli peräisin fossiilisista polttoaineista, maapallon biosfääristä tai valtamerestä.
hiilen isotoopit
hiilen isotooppeja on kolmessa muodossa. Ylivoimaisesti yleisin hiilen isotooppi on hiili-12 (12c), joka sisältää kuuden protoninsa lisäksi kuusi neutronia. Seuraavaksi raskaimmalla hiilen isotoopilla, hiili-13: lla (13C), on seitsemän neutronia. Sekä 12C: tä että 13c: tä kutsutaan stabiileiksi isotoopeiksi, koska ne eivät hajoa muihin muotoihin tai alkuaineisiin ajan kuluessa. Harvinainen hiili-14 (14C) – isotooppi sisältää ytimessään kahdeksan neutronia. Toisin kuin 12C ja 13c, tämä isotooppi on epästabiili eli radioaktiivinen. Ajan myötä 14C-atomi hajoaa stabiiliksi tuotteeksi.

valtaosa kaikesta maapallolla esiintyvästä hiilestä on 12C. lähes 99% kaikesta maapallon hiilestä on tätä muotoa. Vaikka vain noin 1% kaikesta maapallon hiilestä on 13C isotooppista muotoa, 14C on vielä paljon harvinaisempi. Vain yksi biljoonasta hiiliatomista on 14C.
saadaksemme käsityksen siitä, kuinka vähän 14C-atomeja on verrattuna 12C: hen, vertaamme yhdestä biljoonaan. Biljoona on miljoona miljoonaa. Jos asettaisit riviin biljoonan yhden dollarin setelin, se ulottuisi melkein Maasta Aurinkoon!