detaliile tehnice: Chimie
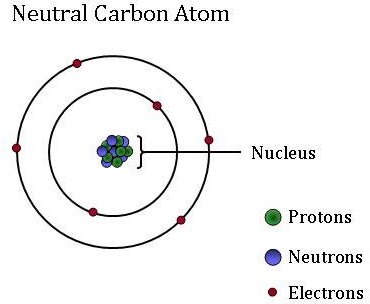
atomii, care sunt unitatea de bază, fundamentală a întregii materii, pot diferi foarte mult unul de celălalt. Deși atomii sunt prea mici pentru a vedea fără a utiliza Microscoape de mare putere, ei sunt compuși din particule și mai mici: protoni, neutroni și electroni.
electronii, care sunt particule extrem de ușoare, încărcate negativ, orbitează în jurul unei mase centrale-nucleul unui atom. Atomii pot câștiga sau pierde electroni, care schimbă sarcina atomului (creând ioni). Cu toate acestea, atomul rămâne același element indiferent dacă are o sarcină pozitivă, negativă sau neutră.
nucleul mic, dens (sau centrul) atomului conține celelalte componente–protonii și neutronii. Protonii sunt particule încărcate pozitiv, iar numărul de protoni este întotdeauna fixat pentru un anumit element. Cu alte cuvinte, numărul de protoni este ceea ce conferă fiecărui element identitatea sa unică, individuală. De exemplu, un atom de carbon are șase protoni, dar un atom cu doar cinci protoni este bor, în timp ce un atom cu șapte protoni este elementul azot.
neutronii sunt neutri – nu au nicio taxă. Izotopii sunt atomi ai aceluiași element care au un număr diferit de neutroni. Deși izotopii aceluiași element sunt gemeni când vine vorba de reactivitate, numărul diferit de neutroni înseamnă că au o masă diferită. Anumiți izotopi sunt mai abundenți în unele materiale decât alții, deoarece unele procese fizice și chimice „preferă” un izotop în locul altuia. Aceste diferențe în abundența izotopică sunt utilizate ca” etichete ” pentru a identifica diferitele surse de CO2 găsite într-o probă de CO2 atmosferică. Oamenii de știință NOAA atmosferici folosesc aceste etichete izotopice pentru a determina ce procent din acel carbon a fost derivat din combustibili fosili, biosfera terestră sau din ocean.
izotopi de Carbon
izotopi de Carbon vin în trei forme. De departe cel mai comun izotop al carbonului este carbon-12 (12C), care conține șase neutroni în plus față de cei șase protoni ai săi. Următorul cel mai greu izotop de carbon, carbon-13 (13C), are șapte neutroni. Atât 12C, cât și 13C sunt numiți izotopi stabili, deoarece nu se descompun în alte forme sau elemente în timp. Izotopul rar de carbon-14 (14C) conține opt neutroni în nucleul său. Spre deosebire de 12C și 13C, acest izotop este instabil sau radioactiv. În timp, un atom de 14C se va descompune într-un produs stabil.

marea majoritate a carbonului găsit pe Pământ este de 12C. aproape 99% din tot carbonul de pe Pământ este de această formă. În timp ce doar aproximativ 1% din tot carbonul de pe Pământ este de forma izotopică 13C, 14C este încă mult mai rar. Doar unul din fiecare trilion de atomi de carbon este 14C.
pentru a obține o idee despre cât de puțini atomi de 14C există în comparație cu 12C, să comparăm unul cu un trilion. Un trilion este un milion de milioane. Dacă ați aliniat un trilion de bancnote de un dolar, s-ar întinde aproape de la pământ la soare!