技術的詳細:化学
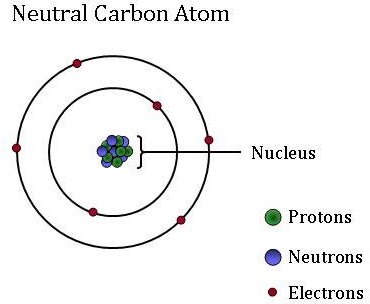
すべての物質の基本的な基本単位である原子は、互いに大きく異なる可能性があります。 原子は高出力の顕微鏡を使用せずに見るには小さすぎますが、陽子、中性子、電子などのより小さな粒子で構成されています。
非常に軽く負に荷電した粒子である電子は、原子の核である中心質量の周りを公転しています。 原子は電子を獲得または失う可能性があり、それは原子の電荷を変化させる(イオンを生成する)。 しかし、原子は、それが正、負、または中性電荷を有するかどうかにかかわらず、同じ要素のままである。
原子の小さくて緻密な核(または中心)には、陽子と中性子という他の成分が含まれています。 陽子は正に荷電した粒子であり、陽子の数は常に特定の元素に対して固定されています。 言い換えれば、陽子の数は、各要素に固有の個々の同一性を与えるものです。 例えば、炭素原子は6個の陽子を持つが、5個の陽子しか持たない原子はホウ素であり、7個の陽子を持つ原子は元素窒素である。
中性子は中性で、電荷はありません。 同位体は、異なる数の中性子を有する同じ元素の原子である。 同じ元素の同位体は反応性に関しては双子ですが、中性子の数が異なることは、それらが異なる質量を有することを意味します。 いくつかの物理的および化学的プロセスは、別のものよりも一つの同位体を”好む”ので、特定の同位体は、他のものよりもいくつかの材料でより豊富 同位体存在量のこれらの違いは、大気中のCO2サンプルに見られるCO2の異なる供給源を識別するための「ラベル」として使用されます。 NOAAの大気科学者は、これらの同位体ラベルを使用して、その炭素のどのパーセントが化石燃料、陸上生物圏、または海洋に由来するかを決定します。
炭素の同位体
炭素同位体には三つの形があります。 炭素の最も一般的な同位体は炭素-12(12C)であり、6つの陽子に加えて6つの中性子を含む。 次に重い炭素同位体である炭素-13(13C)は7つの中性子を持つ。 彼らは時間をかけて他の形や元素に崩壊しないので、12Cと13Cの両方が安定同位体と呼ばれています。 希少な炭素14(14C)同位体は、その核に八つの中性子を含んでいます。 12Cと13Cとは異なり、この同位体は不安定であるか、または放射性である。 時間の経過とともに、14C原子は安定した生成物に崩壊する。

地球上で見つかったすべての炭素の大部分は12Cです。 地球上のすべての炭素の約1%のみが13C同位体形態であるが、14Cは依然としてはるかに稀である。 1兆個の炭素原子のうち1つだけが14Cです。
14C原子が12Cと比較してどれだけ少ないかを知るために、1兆と1兆を比較しましょう。 兆は百万の百万である。 あなたは兆一ドル札を並べた場合、それはほとんど地球から太陽に伸びるだろう!