On sait depuis longtemps que les patients atteints d’un cancer du poumon à petites cellules développent des signes et des symptômes neurologiques avec une fréquence accrue; cependant, de nombreux cancers, notamment d’autres tumeurs pulmonaires, le thymome, la maladie de Hodgkin, d’autres lymphomes, le carcinome des testicules, des ovaires et du sein peuvent également provoquer des syndromes neurologiques paranéoplasiques.
La façon dont les cancers entraînent des symptômes neurologiques paranéoplasiques est incomplètement comprise. Le développement de ces syndromes ne sont pas dus à une invasion tumorale directe. L’expression des antigènes onconeuraux par les cellules cancéreuses entraînant une auto-immunité semble en être le mécanisme. Les anticorps paranéoplasiques classiques sont dirigés contre les antigènes intracellulaires et peuvent ne pas être directement pathogènes. Les expériences de transfert passif ont généralement échoué. Cependant, les anticorps dirigés contre les antigènes exposés, à savoir les récepteurs ganglionnaires de l’acétylcholine et les canaux calciques et potassiques à tension contrôlée, semblent plus directement pathogènes. Avec ces types d’anticorps, plusieurs expériences de transfert passif ont été positives, confirmant l’effet pathogène direct des anticorps.
Les auto-anticorps contre ces protéines membranaires exposées extracellulairement se produisent souvent sans malignité sous-jacente. Une recherche d’une tumeur maligne doit toujours être entreprise, mais ces conditions peuvent survenir par un processus auto-immun idiopathique.
De nombreux anticorps antineuronaux ont été décrits à ce jour, et de nouveaux anticorps sont décrits chaque année. Parfois, plus d’un type d’anticorps est trouvé chez un seul patient, et le même type d’anticorps peut être associé à des syndromes très différents chez d’autres patients. Il est également tout à fait possible qu’un patient qui n’a pas d’auto-anticorps identifiables mais qui a une tumeur connue pour exprimer des épitopes similaires à des structures neuronales (par exemple, un cancer du poumon à petites cellules), puisse souffrir d’un dysfonctionnement autonome paranéoplasique dû à un anticorps qui n’a pas été identifié.
Un dysfonctionnement autonome peut survenir lorsque ce processus auto-immun cause des dommages suffisants au système nerveux autonome. Des données limitées sont disponibles concernant l’attaque immunitaire sur les neurones préganglionnaires ou les voies autonomes centrales. Les changements pathologiques typiques comprennent les infiltrats lymphocytaires et les menottes vasculaires; comme le montre l’image ci-dessous d’un cas d’encéphalomyéloneuropathie anti-Hu. Des attaques similaires sur les neurones autonomes postganglionnaires et myentériques peuvent survenir avec des anticorps antineuronaux.
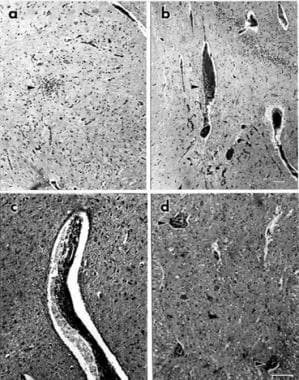 Neuropathie autonome paranéoplasique. Coupes du système nerveux central chez un patient présentant une insuffisance autonome, un carcinome pulmonaire à cellules d’avoine et un titre positif d’anticorps anti-HU colorés à l’hématoxyline et à l’éosine (H & E). (a) Olive inférieure montrant un groupe de cellules mononucléées (pointe de flèche); (b) hippocampe montrant un infiltrat mononucléaire périvasculaire (pointe de flèche); (c) section du mésencéphale montrant un vaisseau enfermé dans un infiltrat mononucléaire; (d) corne ventrale de la moelle épinière thoracique montrant des groupes de cellules mononucléées autour des motoneurones en dégénérescence (pointes de flèche). Les barres de grossissement indiquent 100 mm. La barre en b s’applique également à a et la barre en d s’applique également à c.
Neuropathie autonome paranéoplasique. Coupes du système nerveux central chez un patient présentant une insuffisance autonome, un carcinome pulmonaire à cellules d’avoine et un titre positif d’anticorps anti-HU colorés à l’hématoxyline et à l’éosine (H & E). (a) Olive inférieure montrant un groupe de cellules mononucléées (pointe de flèche); (b) hippocampe montrant un infiltrat mononucléaire périvasculaire (pointe de flèche); (c) section du mésencéphale montrant un vaisseau enfermé dans un infiltrat mononucléaire; (d) corne ventrale de la moelle épinière thoracique montrant des groupes de cellules mononucléées autour des motoneurones en dégénérescence (pointes de flèche). Les barres de grossissement indiquent 100 mm. La barre en b s’applique également à a et la barre en d s’applique également à c. Les syndromes les mieux compris impliquant un dysfonctionnement autonome paranéoplasique sont la gangliopathie autonome auto-immune paranéoplasique (AAG), la neuropathie sensorielle et / ou la neuronopathie paranéoplasique, l’encéphalomyéloneuropathie paranéoplasique et le syndrome myasthénique de Lambert-Eaton.
Anticorps anti-récepteurs ganglionnaires de l’acétylcholine
Ces anticorps dirigés contre l’acétylcholine nicotinique dans des récepteurs contenant la sous-unité α3 exprimée sur les ganglions sympathiques et parasympathiques provoquent une AGA paranéoplasique. Les anticorps ganglionnaires des récepteurs de l’acétylcholine ne se lient pas aux récepteurs musculaires de l’acétylcholine et ne sont pas connus pour provoquer une myasthénie grave (MG). Ces anticorps anti-récepteurs ganglionnaires de l’acétylcholine sont probablement directement pathogènes et présentent un tableau clinique associé généralement caractérisé par une défaillance autonome. Seulement environ 20% des cas d’AGA semblent d’origine paranéoplasique, liés à un carcinome pulmonaire à petites cellules, à un thymome, à un carcinome de la vessie et à un carcinome rectal; la plupart des cas restants semblent être des analogues postinfectieux du syndrome de Gullian-Barre. Un cas d’AAG paranéoplasique coexistant avec des anticorps dirigés contre les récepteurs musculaires de l’acétylcholine a été rapporté.
Anti-Hu
Les anticorps anti-Hu (également appelés anticorps nucléaires antineuronaux de type 1) sont les deuxièmes plus pertinents pour le dysfonctionnement autonome; et sont souvent observés dans le cadre du cancer du poumon à petites cellules. Ces anticorps peuvent également être observés dans le cancer du poumon non à petites cellules, le neuroblastome et les troubles malins du tractus gastro-intestinal, de la prostate, du sein, de la vessie, des reins, du pancréas, des testicules et des ovaires. La réponse auto-immune est dirigée vers l’antigène Hu, une séquence d’ARN m non traduite en 3′ riche en AU qui est exprimée par de nombreuses cellules cancéreuses du poumon à petites cellules et par tous les neurones.
Les anticorps dirigés contre l’antigène onconeuronal Hu peuvent affecter presque n’importe quelle partie du système nerveux central (SNC) ou du système nerveux périphérique. L’anticorps anti-Hu est le plus souvent associé à une neuronopathie sensorielle paranéoplasique, qui implique la destruction des neurones sensoriels primaires. En présence d’anti-Hu, environ 25% des patients présentent une forme de dysautonomie, le plus souvent des manifestations gastro-intestinales. Cet anticorps est utile sur le plan diagnostique, mais le rôle exact de l’immunité humorale dans la dégénérescence neurale reste incertain.
Récepteur anti-NMDA
Un anticorps récemment découvert contre le récepteur NMDA s’est avéré associé à une psychose, à des convulsions et à une instabilité autonome. Dans une série de cas, il s’est avéré être la cause de 4% des cas d’encéphalite. L’anticorps se trouve dans le liquide céphalo-rachidien (LCR) dans 94% des cas. Dans une série de cas, 55% des patients présentaient un tératome contenant du tissu neural avec des récepteurs NMDA exprimés. En règle générale, la tumeur est un tératome ovarien; cependant, des tumeurs des cellules germinales testiculaires, un neuroblastome et un lymphome de Hodgkin ont également été rapportés. Il existe des preuves que l’encéphalite à anticorps du récepteur NMDA peut entraîner une dérégulation du nœud sinusal à médiation centrale, y compris un arrêt cardiaque.
Anti-VGCC
Dans le syndrome myasthénique de Lambert-Eaton (LEMS), des anticorps contre les canaux calciques à déclenchement en tension de type P / Q (VGCC) sont présents. Ces anticorps entraînent une altération de la libération de calcium présynaptique au niveau de la jonction neuromusculaire, entraînant une faiblesse musculaire principalement proximale. Ces anticorps bloquent non seulement les canaux calciques à chaîne de tension au niveau de la jonction neuromusculaire, mais les bloquent également aux bornes nerveuses parasympathiques et sympathiques, créant ainsi une insuffisance autonome et des symptômes autonomes. Ce syndrome est associé à une tumeur maligne 50 à 60% du temps, généralement un cancer du poumon à petites cellules, mais également un cancer du poumon non à petites cellules, un thymome malin, un lymphome, une leucémie et des carcinomes du sein, de la prostate, du larynx et de la vésicule biliaire. Le dysfonctionnement autonome dans le SMLE est normalement léger.
Autres anticorps paranéoplasiques
La protéine médiateur de la réponse à la collapsine (CRMP-5), également connue sous le nom de CV-2, est un autre anticorps paranéoplasique qui a associé un dysfonctionnement autonome dans 33% des cas. Le CRMP-5 est le plus souvent observé avec un cancer du poumon à petites cellules. L’anticorps cellulaire de Purkinje-2 (PCA-2) provoque fréquemment une dégénérescence cérébelleuse, mais peut également être associé à une insuffisance autonome. Les anticorps dirigés contre la synaptophysine peuvent être associés à un cancer du poumon et à des troubles gastro-intestinaux du plexus myentérique. Il a été rapporté que les anticorps du canal potassique à déclenchement en tension (VGKC) provoquent une défaillance autonome dans 33% des cas. Les anticorps VGKC sont associés à des tumeurs neuroendocrines, notamment un carcinome pulmonaire à petites cellules, un rétinoblastome, un oligodendrogliome, un mélanome, un léiomyosarcome et des tumeurs malignes hématologiques. . Il existe un complexe d’anticorps VGKC associé à la protéine associée à la contractine 2 (CASPR2) qui a été observé avec un dysfonctionnement autonome avec un thymome ou un cancer du poumon à petites cellules.
Des troubles paranéoplasiques de dysmotilité gastrique peuvent souvent être observés avec des anticorps tels que anti-Yo, anti-Hu, récepteur de l’acétylcholine anti-ganglionique, CRMP-5, anti-VGCC, anti-VGKC, GAD65, antigène des cellules d’îlots 512 (IA-2), cellules pariétales gastriques, striation musculaire, peroxydase thyroïdienne ou autoanticorps de thyroglobuline. . Un rapport de cas documente un patient présentant une obstruction colique fonctionnelle résultant finalement d’une myasthénie oculaire paranéoplasique associée à un thymome.
Le syndrome de la personne raide, lorsqu’il est causé par un trouble paranéoplasique (environ 5% des cas), s’est associé à des anticorps anti-GAD65, amphiphysine, anti-Ri (anticorps ANNA-2), anti-géphyrine, anti ICA 105 et anti-17-B-hydroxystéroïde déshydrogénase de type 4. Les tumeurs associées se trouvent dans les cancers du sein, du thymus, du poumon et du rein ainsi que dans le myélome multiple.
L’encéphalomyélite progressive avec rigidité et myoclonie (PERM) a une cause paranéoplasique chez 20% des patients associés à l’anti-Ri (ANNA-2), à l’anti-amphiphysine et à l’anti-GAD65. Des symptômes autonomes tels que la pyrexie et la diaphorèse sont exposés chez 66% des patients atteints de PERM.
L’anti-Yo, également connu sous le nom d’anticorps à cellules de Purkinje 1 (PCA-1) est associé aux cancers du sein, de l’ovaire, des trompes de Fallope ou de l’utérus. Il cible un antigène intracellulaire appelé CDR2. La présentation typique est la dysmotilité gastrique.
De nombreux autres auto-anticorps peuvent également jouer un rôle dans la dysautonomie paranéoplasique, d’autres étant détectés chaque année. Des exemples récents incluent la synaptophysine, la SOX, la ZIC, l’anti-AMPA et l’anti-GABA, et des anticorps dirigés contre le récepteur de l’inositol 1,4,5-trisphosphate de type 1 (ITRP1) et la protéine 6 de type dipeptidyl-peptidase (DPP6, également connue sous le nom de DPPX).
L’auto-immunité dans les syndromes neurologiques paranéoplasiques semble conférer un certain degré d’effet antitumoral. Une inflammation similaire à celle observée dans le système nerveux affecte également la tumeur.
Il y a eu plusieurs cas rapportés dans lesquels des anticorps Hu se sont produits avec des symptômes paranéoplasiques classiques qui se sont spontanément résolus sans qu’une tumeur sous-jacente ne soit identifiée. Cela pourrait être dû à une guérison spontanée du cancer sous-jacent, éventuellement due à un effet antitumoral des anticorps paranéoplasiques.