Passiv Transport
for å forstå hvordan stoffer beveger seg passivt over en cellemembran, er det nødvendig å forstå konsentrasjonsgradienter og diffusjon. En konsentrasjonsgradient er forskjellen i konsentrasjonen av et stoff over et rom. Molekyler (eller ioner) vil spre / diffundere fra hvor de er mer konsentrert til hvor de er mindre konsentrert til de er like fordelt i det rommet. (Når molekyler beveger seg på denne måten, sies de å bevege seg ned i konsentrasjonsgradienten.) Tre vanlige typer passiv transport inkluderer enkel diffusjon, osmose og tilrettelagt diffusjon.
Enkel Diffusjon er bevegelsen av partikler fra et område med høyere konsentrasjon til et område med lavere konsentrasjon. Et par vanlige eksempler vil bidra til å illustrere dette konseptet. Tenk deg å være inne i et lukket bad. Hvis en flaske parfyme ble sprayet, ville duftmolekylene naturlig diffundere fra stedet der de forlot flasken til alle hjørner av badet, og denne diffusjonen ville fortsette til det ikke var mer konsentrasjonsgradient igjen. Et annet eksempel er en skje med sukker plassert i en kopp te. Til slutt vil sukkeret diffundere gjennom teen til ingen konsentrasjonsgradient forblir. I begge tilfeller, hvis rommet er varmere eller teen varmere, oppstår diffusjon enda raskere da molekylene støter på hverandre og sprer seg raskere enn ved kjøligere temperaturer. Å ha en indre kroppstemperatur rundt 98,6° F bidrar dermed også til diffusjon av partikler i kroppen.
Besøk denne lenken for å se diffusjon og hvordan den drives av molekylers kinetiske energi i oppløsning. Hvordan påvirker temperaturen diffusjonshastigheten, og hvorfor?
Når et stoff finnes i større konsentrasjon på den ene siden av en semipermeabel membran, for eksempel plasmamembranen, vil ethvert stoff som kan bevege seg ned i konsentrasjonsgradienten over membranen, gjøre det. Vurder stoffer som lett kan diffundere gjennom lipid-dobbeltlaget av cellemembranen, for eksempel gassene oksygen (O2) og CO2. O2 diffunderer vanligvis til celler fordi DET er mer konsentrert utenfor dem, OG CO2 diffunderer vanligvis ut av celler fordi DET er mer konsentrert inne i dem. Ingen av disse eksemplene krever noen energi fra cellen, og derfor bruker de passiv transport for å bevege seg over membranen. Før du går videre, må du vurdere gassene som kan diffundere over en cellemembran. Fordi celler raskt bruker oksygen under metabolisme, er det vanligvis en lavere konsentrasjon Av O2 inne i cellen enn utenfor. Som et resultat vil oksygen diffundere fra interstitialvæsken direkte gjennom lipid-dobbeltlaget av membranen og inn i cytoplasma i cellen. På den annen side, fordi celler produserer CO2 som et biprodukt av metabolisme, ØKER co2-konsentrasjonene i cytoplasma; DERFOR vil CO2 bevege SEG fra cellen gjennom lipid-dobbeltlaget og inn i interstitialvæsken, hvor konsentrasjonen er lavere. Denne mekanismen for molekyler som sprer seg fra hvor de er mer konsentrert til hvor de er mindre konsentrasjon, er en form for passiv transport kalt enkel diffusjon (Figur 3.15).
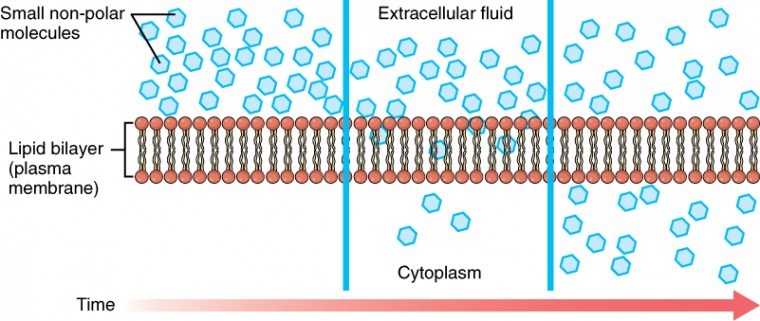
Figur 3.15. Enkel Diffusjon over Cellemembranen (Plasma) strukturen av lipid-dobbeltlaget tillater bare små, ikke-polare stoffer som oksygen og karbondioksid å passere gjennom cellemembranen, ned konsentrasjonsgradienten, ved enkel diffusjon.
Osmose er diffusjonen av vann gjennom en semipermeabel membran (Figur 3.16). Vann kan bevege seg fritt over cellemembranen i alle celler, enten gjennom proteinkanaler eller ved å glide mellom selve membranets lipidhaler. Det er imidlertid konsentrasjon av oppløsninger i vannet som bestemmer hvorvidt vann skal bevege seg inn i cellen, ut av cellen, eller begge deler.

Figur 3.16. Osmose Osmose Er diffusjon av vann gjennom en semipermeabel membran ned sin konsentrasjonsgradient. Hvis en membran er gjennomtrengelig for vann, men ikke til et stoff, vil vann utjevne sin egen konsentrasjon ved å spre til siden av lavere vannkonsentrasjon (og dermed siden av høyere løsningskonsentrasjon). I begeret til venstre er løsningen på høyre side av membranen hypertonisk.
Oppløsninger i en løsning skaper osmotisk trykk, et trykk som trekker vann. Osmose oppstår når det er en ubalanse av oppløsninger utenfor en celle versus inne i cellen. Jo mer løsemiddel en løsning inneholder, desto større er det osmotiske trykket som løsningen vil ha. En løsning som har en høyere konsentrasjon av oppløsninger enn en annen løsning sies å være hypertonisk. Vannmolekyler har en tendens til å diffundere til en hypertonisk løsning fordi det høyere osmotiske trykket trekker vann (Figur 3.17). Hvis en celle er plassert i en hypertonisk løsning, vil cellene skrumpe eller crenate som vann forlater cellen via osmose. I kontrast, en løsning som har en lavere konsentrasjon av løsemidler enn en annen løsning sies å være hypoton. Celler i en hypotonisk løsning vil ta for mye vann og svulme, med risiko for å sprekke, en prosess som kalles lysis. Et kritisk aspekt av homeostase i levende ting er å skape et indre miljø der alle kroppens celler er i en isotonisk løsning, et miljø der to løsninger har samme konsentrasjon av løsemidler (lik osmotisk trykk). Når celler og deres ekstracellulære miljøer er isotoniske, er konsentrasjonen av vannmolekyler den samme utenfor og inne i cellene, slik at vannet strømmer både inn og ut og cellene opprettholder sin normale form (og funksjon). Ulike organsystemer, spesielt nyrene, arbeider for å opprettholde denne homeostasen.

Figur 3.17. Konsentrasjon Av Løsninger en hypertonisk løsning har en løsningskonsentrasjon høyere enn en annen løsning. En isotonisk løsning har en løsningskonsentrasjon som er lik en annen løsning. En hypotonisk løsning har en løsningskonsentrasjon lavere enn en annen løsning.