- wprowadzenie
- materiały i metody
- pacjenci i próbki
- analiza genetyczna
- Analiza statystyczna
- Etyka
- wyniki
- charakterystyka kliniczna pacjentów z chorobą VHL
- czas przeżycia całkowitego i czas przeżycia specyficznego dla CHB u pacjentów z chorobą VHL
- analizy regresji Coxa dla przeżycia całkowitego
- wpływ różnych narządów na przeżycie specyficzne dla CHB
- wpływ wielkości RCC na przeżycie pacjentów
- dyskusja
- data Availability Statement
- Etyka Statement
- autorzy
- finansowanie
- konflikt interesów
- podziękowania
- materiał uzupełniający
- skróty
wprowadzenie
choroba von Hippela-Lindaua (VHL) (MIM 193300) jest autosomalnym dominującym zespołem nowotworowym spowodowanym mutacjami linii germinalnej w genie supresorowym VHL znajdującym się na 3p25. Częstość występowania wynosi ~1 na 36 000-40 000 żywych urodzeń i ma wysoką penetrację (1-3). Łagodne i złośliwe nowotwory, w tym hemangioblastoma ośrodkowego układu nerwowego (CHB), hemangioblastoma siatkówki (RA), rak nerkowokomórkowy (RCC), pheochromocytoma (PHEO), zmiany trzustki, w tym torbielowata zmiana trzustki i guzy neuroendokrynne trzustki (PCL/PNET), guz śródsympatyczny (ELST) i brodawkowaty cystadenomas najądrza lub szerokiego więzadła są głównymi objawami tej choroby (4-11). Zarówno wewnątrz -, jak i międzyamilialna heterogeniczność fenotypowa można zaobserwować u pacjentów z chorobą VHL (12, 13).
wiele badań wykazało, że przeżycie pacjentów z chorobą VHL było gorsze niż w populacji ogólnej. Badanie przeprowadzone w 1990 roku wykazało, że mediana przeżycia wynosiła 49 lat (14). Niedawne badanie wykazało, że szacowana średnia długość życia pacjentów płci męskiej i żeńskiej wynosiła odpowiednio 67 i 60 lat (15). W 2012 r. badanie wykazało, że średnia długość życia pacjentów z chorobą VHL wynosiła 52 lata (16). Wcześniej zgłaszane czynniki ryzyka przeżycia pacjentów z chorobą VHL obejmowały wczesny rok urodzenia, mniejszą liczbę wizyt monitorujących, płeć żeńską, pozytywny wywiad rodzinny, wczesny początek choroby, obcinający Typ mutacji i RCC większy niż 3 cm (15, 17, 18). Jednak żadne wcześniejsze badania nie badały skutków zaangażowania każdego narządu w dużej grupie pacjentów.
wpływ zaangażowania różnych narządów na przeżywalność badano w innych chorobach układowych. Na przykład zajęcie macicy wskazuje na gorsze przeżycie u pacjentów z rozlanym chłoniakiem z dużych limfocytów B niż u pacjentów z udziałem innych narządów (19). Yuda i in. donoszono, że wysięk osierdziowy i zajęcie wielu narządów były czynnikami predyktorami śmiertelności u pacjentów z układową amyloidozą łańcucha lekkiego (20). Chociaż niektóre wcześniejsze badania wykazały korelacje genotypowo-fenotypowe w chorobie VHL: pacjenci z mutacjami missense są bardziej narażeni na rozwój pheochromocytoma, a pacjenci z mutacjami skróconymi są bardziej narażeni na rozwój RCC i CHB (21-23). Istniejące korelacje genotypowo-fenotypowe nie mogą wyjaśnić innych złożonych fenotypów. Dlatego ważne jest badanie rokowania choroby VHL z perspektywy zaangażowania narządów (23, 24).
celem tego badania było zbadanie całkowitego przeżycia i przeżycia specyficznego dla CHB w dużej grupie pacjentów z chorobą VHL, która obejmuje bezobjawowych nosicieli mutacji oraz zbadanie wpływu CHB, RCC, RA, PCL/PNET i PHEO, w celu poprawy poradnictwa genetycznego i strategii leczenia klinicznego pacjentów z chorobą VHL.
materiały i metody
pacjenci i próbki
zrekrutowaliśmy wszystkie informacje o pacjentach zapisane w bazie danych pacjentów z chorobą VHL w pierwszym szpitalu Uniwersytetu Pekińskiego. Diagnoza została ustalona, gdy stwierdzono, że pacjent posiada mutację genu linii germinalnej VHL lub spełnia wcześniej opisane kryteria kliniczne (25, 26). Co najmniej jeden pacjent został zdiagnozowany przez test mutacji VHL w każdej rodzinie, z wyjątkiem pacjentów, którzy odmówili testu. Łącznie zdiagnozowano 376 pacjentów ze 134 rodzin. Dane kliniczne, w tym płeć, wywiad rodzinny, Typ mutacji, wiek początkowy każdego narządu i przyczynę zgonu, uzyskano poprzez przegląd dokumentacji medycznej lub wywiad z członkami rodziny. Czterdziestu pacjentów zostało wykluczonych z badania z powodu niejasnych danych. Ostatecznie do tej kohorty włączono 336 pacjentów ze 125 rodzin, w których 298 pacjentów miało co najmniej jedną zmianę związaną z chorobą VHL, a 38 pacjentów było nosicielami mutacji bezobjawowych.
zarejestrowaliśmy status przeżycia 336 pacjentów od urodzenia do śmierci lub do końca obserwacji w czerwcu 2017 roku. Mediana czasu obserwacji wynosiła 37 lat na osobę (zakres 1-75 lat), a łącznie 12 966 osób.
analiza genetyczna
QIAamp DNA Blood Mini Kit (QIAGEN, Niemcy) został użyty do ekstrakcji genomowego DNA z krwi obwodowej podejrzanych pacjentów. Trzy kodujące eksony i ich flankujące regiony introniczne zostały amplifikowane przez PCR przy użyciu starterów opisanych wcześniej (27). Mutacje Missense, mutacje splicingu i małe indele zostały wykryte przez bezpośrednie sekwencjonowanie. Do wykrywania dużych delecji użyto zestawu wzmacniającego zależnego od ligacji (MLPA, P016-C2, MRC-Holland, Amsterdam). Duże delecje eksonów zostały potwierdzone ilościowym PCR w czasie rzeczywistym za pomocą starterów opisanych przez Ebenazera i wsp. (28). Pacjentów podzielono na Grupę mutacji missense (N = 162) i grupę mutacji obciętych (N = 174) na podstawie kryteriów opisanych wcześniej (18).
Analiza statystyczna
analizowano dane demograficzne pacjentów i podstawowe dane kliniczne przy użyciu statystyk opisowych. Wiek początkowy zmian w różnych narządach porównywano za pomocą testu Kruskala-Wallisa; porównywano parami i oznaczano wartość p po dostosowaniu Bonferroni. Wiek początkowy w grupie OUN i w grupie brzusznej porównywano za pomocą testu U Manna-Whitney ’ a.
ponieważ obserwację prowadzono od urodzenia, u pacjentów przed i po wystąpieniu choroby występuje różne ryzyko przeżycia. Sytuacja ta nie spełnia wymogów modelu ryzyka proporcjonalnego, przez co Analiza regresji Coxa jest nieodpowiednia. Zamiast tego, zaangażowanie każdego narządu traktowano jako współzmienną zależną od czasu w modelu regresji Coxa. Do oceny wpływu CHB, RCC, RZS, PCL/PNET i PHEO na całkowite przeżycie wykorzystano analizy regresji Coxa jedno-i wielowymiarowej. Następnie wykorzystaliśmy analizy regresji Coxa, aby określić wpływ RCC, RZS, PCL / PNET i PHEO na przeżycie specyficzne dla CHB, ponieważ CHB jest najczęstszą przyczyną zgonów u pacjentów z chorobą VHL.
analiza statystyczna została przeprowadzona przy użyciu SPSS 22.0 i oprogramowania GraphPad Prism (wersja 6). P < 0.05 uznano za istotne statystycznie. W przypadku porównań par przeprowadzono korektę Bonferroniego.
Etyka
to badanie zostało zatwierdzone przez Institutional Review Board of Peking University First Hospital (Pekin, Chiny) i uzyskano pisemną zgodę od wszystkich pacjentów.
wyniki
charakterystyka kliniczna pacjentów z chorobą VHL
CHB była najczęstszą zmianą w naszym badaniu, a ponad połowa pacjentów miała zmiany CHB (62,2%). PCL/PNET była drugą najczęstszą zmianą (46,4%). Prawie dwie trzecie chorych zmarło na CHB (66,2%). Częstość występowania CHB i RCC w tym badaniu była zasadniczo zgodna z wynikami poprzednich badań (tabela uzupełniająca 1). Mediana wieku wynosiła ≤ 30 lat w momencie wystąpienia CHB i RZS oraz >30 lat w momencie wystąpienia RCC, PHEO i PCL/PNET (Tabela 1). Połączyliśmy CHB i RZS w grupę ośrodkowego układu nerwowego (OUN), a RCC, PHEO i PCL/PNET w grupę brzuszną. Rozkład wieku wystąpienia choroby w obu grupach przedstawiono na fig. 1. Mediana wieku w momencie wystąpienia nowotworów w grupach brzucha i OUN wynosiła odpowiednio 34 i 29 lat. Test U Manna-Whitneya wykazał, że wiek wystąpienia choroby był znacznie młodszy w grupie OUN niż w grupie brzusznej (P < 0, 001).
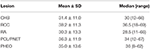
Tabela 1. Wiek na początku zmian związanych z VHL.
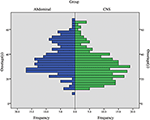
Rysunek 1. Częstość występowania wieku w grupie OUN (w tym u pacjentów z CHB & RZS) i w grupie pacjentów w obrębie jamy brzusznej (w tym u pacjentów z RCC, u pacjentów z PHEO & PCL/PNET).
czas przeżycia całkowitego i czas przeżycia specyficznego dla CHB u pacjentów z chorobą VHL
czas przeżycia całkowitego i czas przeżycia specyficznego dla CHB przedstawiono na fig. 2A, B. mediana czasu przeżycia pacjentów z chorobą VHL wynosiła 66 lat. Łącznie CHB i RCC stanowiły 95,6% wszystkich przypadków śmierci. Prawie dwie trzecie pacjentów zmarło na choroby związane z CHB, a ponad jedna trzecia pacjentów zmarła na RCC. Wśród 209 pacjentów z CHB 45 pacjentów zmarło na CHB, 10 pacjentów zmarło na RCC. Wśród 138 pacjentów z RCC, 16 pacjentów zmarło na RCC, 4 pacjentów zmarło na CHB. Wśród 86 pacjentów z obydwoma zmianami, CHB i RCC przyczyniły się w równym stopniu do zmarłych pacjentów, oba powodują 8 zgonów. CHB było najczęstszą przyczyną zgonów niż RCC w naszym badaniu (Tabela 2).
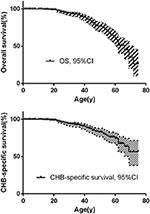
Rysunek 2. A) całkowity czas przeżycia pacjentów z VHL. B) przeżycie specyficzne dla CHB pacjentów z VHL.
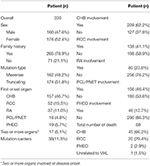
Tabela 2. Wyjściowa charakterystyka kliniczna pacjentów z chorobą VHL.
analizy regresji Coxa dla przeżycia całkowitego
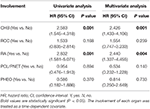
Tabela 3. Analizy regresji Coxa dla przeżycia całkowitego.
wpływ różnych narządów na przeżycie specyficzne dla CHB
, ponieważ CHB stanowiły prawie dwie trzecie zgonów (66.2%, 45 z 68) i CHB był znaczącym czynnikiem ryzyka całkowitego przeżycia w analizach regresji Coxa zarówno jedno -, jak i wielowymiarowej, dalej badaliśmy wpływ zaangażowania innych narządów na przeżycie specyficzne dla CHB. Zaangażowanie każdego narządu traktowano jako współzmienną zależną od czasu.
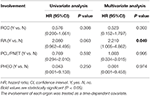
Tabela 4. Wielowymiarowa i wielowymiarowa zależna od czasu regresja Coxa analiza wpływu różnych narządów na przeżycie specyficzne dla CHB.
wpływ wielkości RCC na przeżycie pacjentów
nasza baza danych zawierała tylko 51 pacjentów z pełną historią naturalną RCC. Następnie podzieliliśmy tych pacjentów na 2 grupy: pierwsza grupa, średnica RCC <3 cm w całym ich naturalnym wywiadzie (n = 15), a druga grupa, średnica RCC >3 cm w okresie ich naturalnym (N = 36). Wszyscy pacjenci w pierwszej grupie przeżyli, trzech pacjentów w drugiej grupie zmarło do końca obserwacji; jeden zmarł z powodu choroby związanej z CHB, a dwa pozostałe zmarły z przerzutowego RCC o średnicach RCC 7 i 8,5 cm w momencie rozpoznania.
dyskusja
w tym badaniu CHB i RCC były nadal głównymi przyczynami zgonów u pacjentów z VHL, łącznie spowodowały 95,6% wszystkich zgonów. Przeanalizowaliśmy wpływ każdego zaangażowanego narządu na przeżycie całkowite i przeżycie specyficzne dla CHB u pacjentów z chorobą VHL. CHB i RZS były niezależnymi czynnikami ryzyka całkowitego przeżycia. Co zaskakujące, RCC nie był znaczącym czynnikiem ryzyka całkowitego przeżycia. RZS był jedynym czynnikiem ryzyka przeżycia specyficznego dla CHB. W ostatnich dziesięcioleciach przyczyna śmierci pacjentów z chorobą VHL znacznie się zmieniła. W opublikowanych we wczesnych latach badaniach nad chorobą VHL, CHB i RCC przyczyniły się w przybliżeniu w równym stopniu do śmierci pacjentów; w niektórych badaniach liczba zgonów z powodu RCC była nawet dwukrotnie większa niż liczba zgonów z powodu CHB (29). W ostatnich badaniach odsetek zgonów związanych z CHB był jednak znacznie wyższy niż w przypadku zgonów związanych z RCC (tabela uzupełniająca 1). Taka rozbieżność może częściowo wyjaśnić rozwój zaawansowanych technologii obrazowania i strategii leczenia, w tym terapii celowanej, Chirurgii Małoinwazyjnej i aktywnego nadzoru RCCs, przyczyniając się do wczesnej diagnozy i skutecznego leczenia przed przerzutami RCCs. Z drugiej strony konieczne jest dalsze udoskonalenie farmakologicznego i chirurgicznego leczenia CHB.
chociaż RCC w chorobie VHL jest zwykle uważane za mniej złośliwe i mniej prawdopodobne przerzuty oraz większe przeżycie specyficzne dla raka w porównaniu ze sporadycznymi jasnymi komórkami RCC (30), RCC jest nadal ważną przyczyną zgonów u pacjentów z VHL. Większość zgonów wynika z przerzutów nowotworowych i powikłań związanych z nowotworem. Zaskakująco w tym badaniu wpływ RCC na całkowite przeżycie nie był znaczący. Koreańskie badanie obejmujące 24 pacjentów z chorobą VHL opublikowane w 2009 r. wykazało podobne wyniki (31). Wcześniejsze badania wykazały, że średnica RCC >3 cm jest czynnikiem ryzyka przerzutów i całkowitego przeżycia (17, 32). W bazie danych pacjentów z chorobą VHL analizowaliśmy w tym badaniu, wśród 51 pacjentów z pełną historią naturalną wielkości guza RCC, tylko 3 pacjentów zmarło podczas obserwacji, co uniemożliwiło przeprowadzenie analizy przeżycia. Jilg et al. stwierdzono, że średnia średnica guza u pacjentów bez przerzutów była znacząco mniejsza niż u pacjentów z przerzutami (33). Duffey et al. w 2004 r. poinformowano, że pacjenci z RCC mniejszymi niż 3 cm byli w grupie niskiego ryzyka przerzutów odległych i zalecali 3 cm jako wartość odcięcia dla interwencji chirurgicznej (34). RCC jest nadal ważną przyczyną zgonów u pacjentów z chorobą VHL. Wielkość guza i tempo wzrostu mogą mieć większe znaczenie dla rokowania. Konieczne są większe badania z dłuższymi okresami obserwacji w celu zbadania zależności między przeżywalnością a RCCs.
chociaż CHB jest uważany za łagodny guz, może powodować poważne wady neurologiczne, takie jak wodogłowie, przepuklina i kompresja pnia mózgu, aw rzadkich przypadkach krwotok wewnątrzczaszkowy (14, 29). Powikłania okołooperacyjne / pooperacyjne mogą również prowadzić do śmierci u pacjentów z CHB. Częstość występowania CHB w badanej próbce może wpływać na analizę przeżycia. U 62,2% (209 z 336) pacjentów stwierdzono CHB w naszym badaniu, co jest poniżej średniej liczby pacjentów z CHB w badaniach wymienionych w dodatkowej Tabeli 1. CHB było 66.2% wszystkich pacjentów zgonów w tej kohorcie, co jest wyższe niż 6 z 7 badań wymienionych w dodatkowej Tabeli 1. Może to być spowodowane urodzeniem pacjentów. W duńskim badaniu opublikowanym w 2016 r.wskaźnik zgonów związanych z CHB wzrósł z 42% (rok urodzenia 1901-1955, 18 z 50) do 83% (rok urodzenia 1956-2010, 5 z 6) wraz ze wzrostem roku urodzenia, przy łącznym wskaźniku zgonów związanych z CHB wynoszącym 51%. Autor przypisał taką rozbieżność postępom w diagnostyce i leczeniu RCC (15). Jednak w naszym badaniu 83,3% (280 z 336) pacjentów urodziło się po 1955 roku, tylko 16,7% (56 z 336)pacjentów urodziło się przed 1955 rokiem. Wskaźnik zgonów związanych z CHB wynosił 60,1% dla pacjentów urodzonych przed 1955 r., ale wzrósł do 70,1 i 75% dla pacjentów urodzonych w latach 1955-1975 i po 1975 r. RZS powoduje ślepotę; jednak w naszym badaniu RZS był istotnym czynnikiem ryzyka całkowitego przeżycia i przeżycia specyficznego dla CHB. Siatkówka embriologicznie pochodzi z mózgu, a zarówno CHB, jak i RA mają te same struktury histopatologiczne (7). Onkogeneza hemangioblastoma jest związana z dysregulacją szlaku HIF prowadzącą do wzrostu czynnika wzrostu śródbłonka naczyniowego i erytropoetyny (35, 36). Franke i in. donosił, że delecja mutacji w genie VHL miała większe ryzyko CHB i RA (37). Tak więc, stawiamy hipotezę, że RZS może odzwierciedlać większe obciążenie CHB, co prowadzi do niekorzystnego przeżycia pacjentów z chorobą VHL.
Hemangioblastoma jest istotnym czynnikiem ryzyka przeżycia. Innym możliwym wyjaśnieniem tego jest wcześniejszy wiek wystąpienia tego guza. Nasze wcześniejsze badania wykazały, że wiek wczesny był czynnikiem ryzyka przeżycia całkowitego i przeżycia specyficznego dla choroby VHL (18). Mediana wieku na początku CHB i RZS wynosiła 28.5 i 30 lat, odpowiednio, będąc najwcześniejszym spośród wszystkich zmian związanych z VHL. Gdy CHB i RZS były łączone w grupie OUN, grupa ta miała również wcześniejszy wiek niż grupa brzuszna. Przeprowadziliśmy Test Kruskala-Wallisa w celu porównania wieku początkowego zmian w 5 narządach, A P < 0,001 sugeruje znaczącą różnicę. Następnie dokonaliśmy porównań parami i wartość P została wyceniona po dostosowaniu Bonferroni i stwierdzono istotne różnice w początku wieku między RA-PCL / PNET, RA-RCC, CHB-PCL/PNet i CHB-RCC (tabela uzupełniająca 2). Dlatego, chociaż hemangioblastoma jest uważana za łagodny nowotwór, jego wczesny początek może pogorszyć przeżywalność pacjentów z chorobą VHL.
kilka wcześniejszych badań, w których brali udział tylko pacjenci z objawami, może mieć tendencyjne wyniki, które przeceniają częstość występowania zaangażowanych narządów i wpływ zaangażowanych narządów na przeżycie pacjenta (31, 38). Po raz pierwszy użyliśmy zależnej od czasu analizy regresji Coxa do oceny wpływu każdego zaangażowanego narządu na przeżycie pacjentów z chorobą VHL. W poprzednim badaniu całkowite przeżycie obliczono od rozpoznania choroby do śmierci; jednakże bezobjawowi nosiciele mutacji mogą rozwinąć guzy później i nie spełniają wymogów modelu proporcjonalnego ryzyka (17).
to duże retrospektywne badanie koncentrowało się na różnym zaangażowaniu narządów w przeżywalność pacjentów z chorobą VHL z klinicznego punktu widzenia. Średnia długość życia pacjentów z chorobą VHL wynosiła 66 lat. Obecność CHB i RZS były niezależnymi czynnikami ryzyka całkowitego przeżycia. RCC nie był znaczącym czynnikiem ryzyka całkowitego przeżycia. RZS był czynnikiem ryzyka przeżycia specyficznego dla CHB. Pacjenci z reumatoidalnym zapaleniem stawów powinni być uważnie obserwowani ze względu na większe ryzyko zgonu z powodu CHB. W celu zbadania wpływu RCC na przeżycie pacjentów z VHL konieczne są dalsze większe badania z dłuższymi okresami obserwacji. Wyniki te mogą pomóc w przyszłym poradnictwie genetycznym i podejmowaniu decyzji klinicznych.
data Availability Statement
zbiory danych wygenerowane dla tego badania są dostępne na żądanie autora korespondencyjnego
Etyka Statement
badania z udziałem ludzi zostały zweryfikowane i zatwierdzone przez Institutional Review Board of Peking University First Hospital (Pekin, Chiny). Pisemną świadomą zgodę na udział w badaniu udzielił opiekun prawny/najbliższy krewny uczestników.
autorzy
BZ i JW zajmowały się danymi klinicznymi. SL i XP wykonały prace statystyczne. BH i JZho przeszczepili rękopis. KM i JZha dostarcza ryciny i tabele. Wszyscy autorzy poprawili manuskrypt.
finansowanie
praca ta została wsparta przez fundusze badań podstawowych uniwersytetów centralnych (grant bmu2018ji002).
konflikt interesów
autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
autorzy dziękują Li Xue-ying z Wydziału Statystycznego pierwszego szpitala Uniwersytetu Pekińskiego za pomoc w analizach statystycznych, oraz Bu Ding-Fang, Medical Experiment Center, pierwszego szpitala Uniwersytetu Pekińskiego, za pomoc techniczną.
materiał uzupełniający
skróty
CHB, hemangioblastoma ośrodkowego układu nerwowego; RZS, hemangioblastoma siatkówki; RCC, rak nerkowokomórkowy; PHEO, pheochromocytoma; PCL/PNET, torbielowate uszkodzenie trzustki i nowotwory neuroendokrynne trzustki.
7. Webster AR, Maher ER, Moore AT. Charakterystyka kliniczna angiomatozy ocznej w chorobie von Hippela-Lindaua i korelacja z mutacją linii zarodkowej. Arch Ophthalmol. (1999) 117:371–8. doi: 10.1001 / archopht.117.3.371
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
10. Wanebo JE, Lonser RR, Glenn GM, Oldfield EH. Historia naturalna hemangioblastoma ośrodkowego układu nerwowego u pacjentów z chorobą von Hippela-Lindaua. J Neurochirurg. (2003) 98:82–94. doi: 10.3171 / jns.2003.98.1.0082
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
13. Webster AR, Richards FM, MacRonald FE, Moore AT, Maher ER. An analysis of phenotypic variation in the family cancer syndrome von Hippel-Lindau disease: evidence for modifier effects. Am J Hum Genet. (1998) 63:1025–35. doi: 10.1086/302037
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
19. El-Galaly TC, Cheah CY, Hutchings M, Mikhaeel NG, Savage KJ, Sehn LH, et al. Zajęcie żeńskiego narządu rozrodczego macicy, ale nie jajnika, podczas prezentacji przez rozproszone chłoniaki z dużych limfocytów B jest związane z słabym wynikiem i wysoką częstością wtórnego zajęcia OUN. Br J Haematol. (2016) 175:876–83. 10.1111 / bjh14325
CrossRef Pełny Tekst / Google Scholar
20. Yuda S, Hayashi T, Yasui K, Muranaka a, Ohnishi H, Hashimoto A, et al. Wysięk osierdziowy i zajęcie wielu narządów są niezależnymi czynnikami predyktorami śmiertelności u pacjentów z układową amyloidozą o łańcuchu lekkim. Intern Med. (2015) 54:1833–40. doi: 10.2169 / lekarstwa wewnętrznego.54.3500
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
27. Wu P, Zhang N, Wang X, ning X, Li T, Bu D i in. W wywiadzie rodzinnym choroba von Hippela-Lindaua występowała niezbyt często u pacjentów z Chin: sugeruje to większą częstość występowania mutacji de novo w genie VHL u tych pacjentów. J Hum Genet. (2012) 57:238–43. doi: 10.1038 / jhg.2012.10
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
30. Neumann HP, Bender BU, Berger DP, Laubenberger J, Schultze-Seemann w, Wetterauer U, et al. Występowanie, morfologia i biologia raka nerkowokomórkowego w chorobie von Hippela-Lindaua w porównaniu do sporadycznego raka nerkowokomórkowego. J Urol. (1998) 160:1248–54. doi: 10.1016 / S0022-5347(01)62509-6
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
31. Kim WT, Ham ws, Ju HJ, Lee js, Lee js, Choi yd. Charakterystyka kliniczna raka nerkowokomórkowego u koreańskich pacjentów z chorobą von Hippela-Lindaua w porównaniu ze sporadycznym, obustronnym lub wieloogniskowym rakiem nerkowokomórkowym. J Korean Med Sci. (2009) 24:1145–9. doi: 10.3346 / jkms.2009.24.6.1145
CrossRef Pełny Tekst / Google Scholar
35. Wizigmann-Voos S, Breier G, Risau W, Plate KH. Up-Regulacja czynnika wzrostu śródbłonka naczyniowego i jego receptorów w naczyniakach naczyniakomięśniaków związanych z chorobą von Hippela-Lindaua i sporadycznych. Cancer Res. (1995) 55: 1358-64.
PubMed Abstract / Google Scholar
36. Krieg M, Marti HH, Plate KH. Koekspresja erytropoetyny i czynnika wzrostu śródbłonka naczyniowego w guzach układu nerwowego związanych z utratą funkcji genu supresorowego guza von Hippela-Lindaua. Krew. (1998) 92:3388–93.
PubMed Abstract / Google Scholar
37. Franke g, Bausch B, Hoffmann MM, Cybulla m, Wilhelm C, Kohlhase J, et al. Rekombinacja Alu-Alu leży u podstaw większości dużych delecji linii zarodkowej VHL: charakterystyki molekularnej i korelacji genotypowo-fenotypowej u pacjentów z VHL. Hum Mutat. (2009) 30:776–86. doi: 10.1002 / humu.20948
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar