El indio es un metal plateado brillante que es tan suave y maleable que puede rayarse con una uña y doblarse en casi cualquier forma. En la naturaleza, el indio es bastante raro y casi siempre se encuentra como oligoelemento en otros minerales, particularmente en el zinc y el plomo, a partir de los cuales se obtiene típicamente como subproducto. Su abundancia estimada en la corteza terrestre es de 0,1 partes por millón (ppm), un poco más abundante que la plata o el mercurio, según la Royal Society of Chemistry.
El indio tiene un punto de fusión bajo para un metal: 313.9 grados Fahrenheit (156,6 grados Celsius). A cualquier temperatura por encima de esta, arde con una llama violeta o índigo. El nombre de indio se deriva de la brillante luz índigo que muestra en un espectroscopio.
Solo los hechos
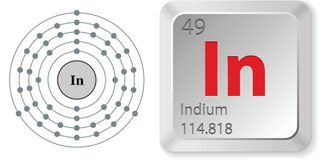
- Número atómico (número de protones en el núcleo): 49
- Símbolo atómico (en la tabla periódica de los elementos): En
- Peso atómico (masa media del átomo): 114.8.8
- Densidad: 7,31 gramos por centímetro cúbico
- Fase a temperatura ambiente: Sólido
- Punto de fusión: 313,88 grados F (156.6 grados C)
- Punto de ebullición: 3,761. 6 F (2,072 C)
- Número de isótopos (átomos del mismo elemento con un número diferente de neutrones): 35 cuyas semividas se conocen; 1 estable; 2 de origen natural
- isótopo más común: En-115
Descubrimiento
El indio fue descubierto en 1863 por el químico alemán Ferdinand Reich en la Escuela de Minas de Freiberg en Alemania. Reich estaba estudiando una muestra de una mezcla de minerales de zinc que pensó que podría contener el recientemente descubierto elemento talio. Después de asar el mineral para eliminar la mayor parte del azufre, aplicó ácido clorhídrico a los materiales restantes. Luego observó que aparecía un sólido amarillento. Sospechó que podría ser el sulfuro de un nuevo elemento, pero como era daltónico, pidió al químico alemán Hieronymous T. Richter que examinara el espectro de la muestra. Richter notó una línea brillante de color violeta, que no coincidía con la línea espectral de ningún elemento conocido.
Trabajando juntos, los dos científicos aislaron una muestra del nuevo elemento y anunciaron su descubrimiento. Llamaron al nuevo elemento indio, por la palabra latina indicum, que significa violeta. Desafortunadamente, su relación se agrió cuando Reich se enteró de que Richter había afirmado ser el descubridor, según la Royal Society of Chemistry(RSC).
Usos
Más de un siglo después del descubrimiento del indio, el elemento seguía en relativa oscuridad ya que nadie sabía qué hacer con él. Hoy en día, el indio es vital para la economía mundial en forma de óxido de indio y estaño (indi). Esto se debe a que IT sigue siendo el mejor material para satisfacer la creciente necesidad de pantallas LCD (pantallas de cristal líquido) en pantallas táctiles, televisores de pantalla plana y paneles solares.
IT tiene varias propiedades que lo hacen perfecto para pantallas LCD y otras pantallas planas: Es transparente, conduce electricidad, se adhiere fuertemente al vidrio, resiste la corrosión y es química y mecánicamente estable.
IT también se usa comúnmente para hacer recubrimientos finos para vidrio y espejos. Cuando se cubre sobre los parabrisas de aviones o automóviles, por ejemplo, IT permite que el vidrio se deshielo o se deshielo, y puede reducir los requisitos de aire acondicionado.
La creciente demanda de LCD ha aumentado considerablemente los precios del indio en los últimos años, según la RSC. Sin embargo, el reciclaje y la eficiencia de la fabricación han ayudado a crear un buen equilibrio entre la oferta y la demanda.
El indio se usa comúnmente para hacer aleaciones y a menudo se conoce como la «vitamina de metal», lo que significa que los pequeños niveles de indio pueden hacer una diferencia drástica en una aleación, según el RSC. Por ejemplo, agregar pequeñas cantidades de indio a las aleaciones de oro y platino las hace mucho más difíciles. Las aleaciones de indio se utilizan para recubrir los rodamientos de motores de alta velocidad y otras superficies metálicas. Sus aleaciones de baja fusión también se utilizan en cabezales de rociadores, enlaces de puertas cortafuego y tapones fusibles.
El metal indio permanece inusualmente blando y maleable a temperaturas muy bajas, lo que lo hace perfecto para su uso en herramientas necesarias en condiciones extremadamente frías, como bombas criogénicas y sistemas de alto vacío. Otra cualidad única es su adherencia, por lo que es muy útil como soldadura.
El indio se utiliza en la fabricación de diversos dispositivos eléctricos, como rectificadores (dispositivos que convierten una corriente alterna en una directa), termistores (una resistencia eléctrica dependiente de la temperatura) y fotoconductores (dispositivos que aumentan su conductividad eléctrica cuando se exponen a la luz).
Fuente & abundancia
El indio rara vez se encuentra sin combinar en la naturaleza y se encuentra típicamente en minerales de zinc, hierro, plomo y cobre. Es el elemento 61 más común en la corteza terrestre y alrededor de tres veces más abundante que la plata o el mercurio, según el Servicio Geológico de los Estados Unidos (USGS). Se estima que representa alrededor de 0,1 partes por millón (ppm) en la corteza terrestre. En peso, se estima que el indio es de 250 partes por billón (ppb), según Chemicool. El indio natural es una mezcla de los isótopos I-115 (95,72 por ciento) e I-113 (4,28 por ciento), según la Enciclopedia Británica.
La mayoría del indio comercial proviene de Canadá y es de alrededor de 75 toneladas por año. Se estima que las reservas de metal superan las 1.500 toneladas. Los suelos cultivados a veces son más ricos en indio que los suelos no cultivados con algunos niveles de hasta 4 ppm, según Lenntech.
¿Quién sabía?
- Indium metal emite un «grito» agudo cuando se dobla. Similar al» grito de lata», este grito suena más como un sonido crepitante.
- El indio es similar al galio en que moja fácilmente el vidrio y es muy útil para fabricar aleaciones de baja fusión. Una aleación que consiste en un 24 por ciento de indio y un 76 por ciento de galio es líquida a temperatura ambiente.
- La primera aplicación de indio a gran escala fue un revestimiento para rodamientos en motores de aviones de alto rendimiento en la Segunda Guerra Mundial, según el USGS.
- Se han encontrado especímenes de metal indio sin combinar en una región de Rusia, según Lenntech.
Mejores baterías
El revestimiento de indio podría dar lugar algún día a baterías de litio recargables más potentes y duraderas, según un estudio publicado en la revista Angewandte Chemie. El revestimiento de indio ofrecería un depósito más uniforme de litio durante la carga, amortiguaría cualquier reacción lateral negativa y aumentaría el almacenamiento.
Una batería de iones de litio es un tipo de batería recargable que se usa comúnmente en tecnologías portátiles, como teléfonos celulares y computadoras portátiles. Durante la descarga, los iones de litio se mueven del electrodo negativo (ánodo) al electrodo positivo (cátodo). Mientras la batería se está cargando, los iones de litio viajan en la dirección opuesta: el electrodo negativo se convierte en cátodo y el electrodo positivo se convierte en ánodo.
Actualmente, las baterías de iones de litio utilizan ánodos hechos de grafito que se utilizan para almacenar litio cuando la batería está cargada. Una alternativa prometedora al uso de grafito serían los ánodos metálicos, como el metal de litio, que podrían ofrecer una capacidad de almacenamiento mucho mayor. Sin embargo, un problema importante con el uso de ánodos metálicos es que hay una deposición desigual del metal mientras la batería se está cargando. Esto conduce a la formación de dendritas (una masa cristalina con una estructura ramificada en forma de árbol). Después de un uso prolongado, estas dendritas crecen tanto que cortocircuitan la batería.
Otro problema con los ánodos metálicos es que causan reacciones laterales indeseables entre los electrodos de metal reactivos y el electrolito (el material que permite que la electricidad fluya entre los electrodos positivos y negativos). Estas reacciones pueden reducir significativamente la vida útil de la batería.
Investigadores del Instituto Politécnico Rensselaer y la Universidad de Cornell han introducido una nueva alternativa: recubrir el litio en una solución de sal de indio. La capa de indio es uniforme y autorreparable cuando el electrodo está en uso. Su composición química sigue siendo la misma, y permanece intacta durante los ciclos de carga / descarga, evitando reacciones secundarias, según el comunicado de prensa del estudio en Science Daily. Las dendritas también se eliminan, lo que permite que la superficie permanezca lisa y compacta.