kertyvä näyttö viittaa siihen, että fosforylaation/defosforylaation signaloinnin häiriöt liittyvät solujen patologiseen käyttäytymiseen. Fosforiproteiinihankkeissa on havaittu lähes 300 000 fosforyloitua ser/Thr/Tyr-jäämää soluproteiineissa . Samaan aikaan human genome project paljasti noin 500 proteiinikinaasia. Silti jokaiseen fosforylaatiokohtaan on osoitettu rajallinen määrä proteiinikinaaseja.
in-gel-fosforylaatiokoe on ollut kätevä menetelmä PROTEIINIKINAASIAKTIIVISUUDEN havaitsemiseksi SDS: llä liukoisissa näytteissä. Tätä menetelmää käytettiin CaMKII: n, MYPT1-K: n (tai ZIPK: n) ja muiden tunnistamiseen . Tässä määritysprotokollassa proteiinikinaasit Ladataan substraattipolypeptidiin upotettuun SDS-polyakryyliamidigeeliin, minkä jälkeen niille tehdään renaturaatio, fosforylaatio radioaktiivisen ATP: n avulla ja sen jälkeen autoradiografia fosforyloidun substraatin havaitsemiseksi. Lisäksi nitroselluloosan tai polyvinylideenifluoridin (PVDF) kalvolla on havaittu kinaasien autofosforylaatiota radioaktiivisen ATP: n avulla . Radioaktiivinen aine voi olla käyttäjille rajoitus turvallisuusmääräysten vuoksi. Lisäksi fosforyloitujen proteiinien autoradiogrammeista puuttuu tietoa fosforylaatiopaikoista.
tässä optimoimme ei-radioaktiivisen vaihtoehtoisen määrityksen perinteiselle geelin sisäiselle fosforylaatiomääritykselle. Nimellä kinaasi activity-tagged western blotting (KAT-WB) tämä tunnistaa onnistuneesti Tyr-kinaasit, jotka autofosforyloivat itsensä, sekä Ser/Thr-kinaasit, jotka fosforyloivat substraattiproteiinia tietyssä kohdassa käyttäen fosfo (P) – spesifisiä vasta-aineita.
kuvassa 1 esitetään Tyr-kinaasin autofosforylaatiomäärityksen Kat-WB-tiedot. Kahden blotin valmistamiseksi kaksi aliquotia uutetta lastattiin SDS-polyakryyliamidigeeliin, jolle tehtiin elektroforeesi, ja sitten proteiinit siirrettiin PVDF-kalvolle (0,2 µm). Kalvoa käsiteltiin peräkkäin puskuroidulla 2-propanolilla, 6, 0 M guanidiinihydrokloridilla (Gu-HCl), 3, 0 M Gu-HCl: llä, 0, 1 M Gu-HCl: llä ja renaturaatiopuskurilla (KS.lisäpöytäkirja). Yön yli kestäneen renaturointivaiheen jälkeen 4°C: ssa kalvo leikattiin pituussuunnassa, jolloin syntyi kaksi kaksoiskappaletta (Kuva 1). Yhtä kalvonpalaa inkuboitiin 60 min 1 mM MgATP: llä. Toinen kalvonpala inkuboitiin ilman mgatp: tä kontrollina. Molemmille levyille tehtiin samanaikaisesti immunodetektio anti-P-Tyr-vasta-aineella (klooni PY20 1:5000 laimennoksella). Kuten kuviosta 1 ilmenee, kontrollikalvossa (ylhäällä vasemmalla) havaittiin useita P-Tyr-vyöhykkeitä 100, 70, 45 ja 35 kDa: ssa. Nämä P-Tyr-proteiinit olivat oletettavasti fosforyloituneet jo ennen uuttamista. Inkubaatio mgatp: llä erottamisen jälkeen nosti proteiinin Tyr-fosforylaatiota 45 kDa: n lämpötilassa sydänlihaslysaateissa (Kuva 1, oikealla ylhäällä, kaista 2), mikä viittaa Tyr-jäämien autofosforylaatioon tässä kinaasissa kalvolla renaturaation jälkeen. Kuvassa 1 esitetään kaistan 2 tiheysmittarit (-/+ MgATP). Jotta varmistettaisiin, että molempiin blotteihin kohdistuu vastaava proteiinikuormitus, suodattimiin tehtiin Coomassie-värjäys (kuva 1, pohja). Tekninen huomautus on, että menetelmän kehittämisen aikana havaitsimme, että puskuroidulla 2-propanolilla ja 6M Gu-HCl: llä tehdyt hoidot olivat molemmat välttämättömiä kinaasiaktiivisuuden havaitsemiseksi. Siksi KAT-WB havaitsi 45 kDa: n Tyr-kinaasin.

hiiren luurankolihaksen (31 µg), sydänlihaksen (28 µg) ja Neuro2a-solujen (27 µg) kokonaisproteiineille tehtiin KAT-western-blottaus. Renaturoinnin jälkeen kalvo leikattiin pituussuunnassa kahtia, ja jokaista osaa inkuboitiin 60 minuuttia 37°C: n lämpötilassa 1 mM: n ATP: n puuttuessa (vasen) tai (oikea). Tyr-fosforylaatio havaittiin tavanomaisella sähkökemiluminesenssimenetelmällä, jossa käytettiin anti-P-Tyr-vasta-ainetta (top). Immunoblottauksen jälkeen jokaisen läikän kokonaisproteiinit visualisoitiin coomassie-värjäyksellä (pohja). Oikealla olevat numerot osoittavat merkkiproteiinien molekyylipainot (kDa). Oikealla oleva ruutu osoittaa kaistan 2 tiheysmittarit vasemmassa ja oikeassa paneelissa. Blottien kirkkauden ja kontrastin tasot ovat identtiset.
toinen versio KAT-WB: stä käyttää PVDF-kalvolle absorboituneen substraattiproteiinin paikkasidonnaista fosforylaatiota kinaasin läheisyydessä. Käytimme fosfataasin holoentsyymin inhibiittori-1: tä (PHI-1) kiinnostavana proteiinina, jonka fosforylaatio thr57: ssä muuttaa tämän soluproteiinin tyypin 1 Ser/Thr-fosfataasin inhibiittoriksi . Kuvassa 2a esitetään KAT-WB-tiedot käyttäen positiivisena kontrollina rekombinantti ZIPK: ta, ser/Thr-kinaasia, jonka tiedetään fosforyloivan rekombinantti PHI-1: n thr57: ssä . Denaturoinnin ja vaiheittaisen renaturointiprosessin jälkeen kalvoa liotettiin yön yli 4°C: ssa renaturaatiopuskurissa, jota täydennettiin rekombinantilla PHI-1 wild typellä (WT) tai fosforyloimattomalla versiolla (T57H) 0,2 mg/ml, minkä jälkeen fosforylaatioreaktio suoritettiin mgatp: llä. Kalvon fosforyloitunut PHI-1 havaittiin anti-P-PHI-1 (Thr57) – vasta-aineella , ja tämä paljasti rekombinantti ZIPK: n kaistan. Ohjauskalvoilla havaittiin kuitenkin vain heikko signaali ilman PHI-1: tä tai PHI-1: n t57h-versiolla. Nämä tiedot viittaavat siihen, että kalvossa olevat toistokyllästetyt kinaasit kykenevät fosforyloimaan substraatteja, jotka myös imeytyvät kalvoon. KAT-WB: tä käytettiin useiden PHI-1-kinaasien havaitsemiseen kudoksissa ja soluissa (Kuva 2b). Rotan luustosta, sydänlihaksista ja Neuro2a-soluista otetuille uutteille tehtiin KAT-WB-määritys. Verrattuna ei-ATP-kontrolliin (vasemmalla, ylhäällä), P-PHI-1: n signaalit ilmaantuivat 1 mM MgATP: llä inkuboituun läiskään (oikealla, ylhäällä). Neuro2a-solulysaateissa havaittiin merkittäviä P-PHI-1-pitoisuuksia 100, 60 ja 49 kDa (kaista 3, avoin nuolenkärki). Kaistalla ei kuitenkaan havaittu P-PHI-1: n bändejä luuston ja sydämen lihasten uutteilla (kaistat 1 ja 2). Fosforylointivaihe ei tehostanut P-PHI-1-signaalia ilman PHI-1: tä (kuva 2, pohja, tyhjä: BLK). Nämä tulokset osoittavat, että hermosoluissa on useita PHI-1-kinaaseja, mutta ei luusto-tai sydänlihaksissa. Tämä tarjoaa meille tehokkaan työkalun useiden substraattispesifisten kinaasien havaitsemiseen soluissa ja kudoksissa. Tekninen huomautus on, että PHI-1: llä tehtävä yön yli kestävä renaturaatio oli tarpeen fosforylaatiosignaalien havaitsemiseksi ja että PHI-1: n suurempi pitoisuus ei lisännyt värjäytymisvoimakkuutta (ei esitetty).
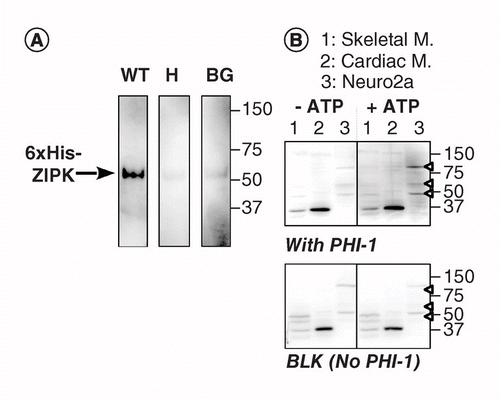
(A) kolminkertainen blotti valmistettiin käyttämällä rekombinanttia ZIPK: ta, joka on osittain puhdistettu solujen lysaateista ja josta ilmenee 6× His-merkitty versio. Elektroblottauksen ja denaturointi–renaturaatioprosessin jälkeen kalvoa inkuboitiin yön yli rekombinantilla PHI-1-proteiinilla (WT: vasemmalla; T57H: keskellä) 0, 2 mg/ml: lla tai ilman PHI-1: tä (BG). Tämän jälkeen jokaista kalvoa inkuboitiin 1 mM ATP: llä 37°C: ssa ja sille tehtiin immunodetektio anti-P-PHI-1 (T57) – vasta-aineella. B) kaksi päällekkäistä blottia (ylä-ja alaosa) on valmistettu käyttäen kokonaisproteiininäytteitä Kuvan 1 mukaisesti. Rekombinantti PHI-1 (0, 2 mg/ml) lisättiin renaturaatiopuskuriin laikkua (top) varten. BLK osoittaa blotin ilman rekombinanttia PHI-1-hoitoa. Inkubaation jälkeen, kun 1 mM ATP: tä ei ollut (vasemmalla) eikä (oikealla), blotit altistettiin immunodetektiolla anti-P-PHI-1: llä (Thr57). Nuolenkärjet oikealla osoittavat P-PHI-1: n sijainnit oikeassa yläkulmassa. Blottien kirkkauden ja kontrastin tasot ovat identtiset.
bg: Background; WT: Wild-type.
näiden tietojen perusteella ehdotamme, että KAT-WB pystyy havaitsemaan Tyr-kinaasien autofosforylaation ja selektiivisten substraattiproteiinien paikkasidonnaisen fosforylaation useiden kudoksissa ja soluissa esiintyvien proteiinikinaasien avulla. KAT-WB: llä on periaatteessa samat edut kuin perinteisellä geelinsisäisellä fosforylaatiomäärityksellä, joka havaitsee kinaasiaktiivisuutta raakaseoksessa, kuten soluuutteissa, paljastaen niiden molekyylikoot . Toinen näiden kahden määrityksen etu on se, että solujen kinaasien translaation jälkeiset muutokset (PTMs) voidaan säilyttää halutussa ajassa tietyissä olosuhteissa, koska näiden määritysten näytteet denaturoidaan nopeasti puskurilla, mukaan lukien SDS, mikä estää fosforylaation ja defosforylaation uutteissa . Useimpia proteiinikinaaseja säädellään PTM: n avulla. KAT-WB pystyy seuraamaan kinaasitoimintojen vaihteluita, vaikka sääteleviä PTM: iä ei ole vielä määritelty. Kat-WB ei pysty havaitsemaan jokaista kinaasia soluuutteissa, koska vain monomeeriset entsyymit, jotka uusiutuvat tehokkaasti käytetyissä olosuhteissa, osoittavat aktiivisuutta. KAT-WB: n muutoksilla pitäisi kuitenkin pystyä havaitsemaan kalmoduliinin ja sykliinien säätelemät kinaasit, kuten on tehty in-gel-fosforylaatiomäärityksellä . Renaturaatiotehokkuuden parantaminen ja yhdistelmä immunoprecipitaation/immunodepletaation kanssa kinaasien vasta-aineilla voi laajentaa menetelmän hyödyllisyyttä.
on huomionarvoista, että fosforylaation lisäksi Kat-WB-protokollan periaatetta voidaan soveltaa muiden PTM-entsyymien, kuten asetylaasien, metylaasien ja ubikitiiniligaasien havaitsemiseen, kun PTM-spesifisiä vasta-aineita on saatavilla. Yhdessä vasta-aineiden, jotka tunnistavat paikkasidonnaisen PTMs: n, kehittämisen kanssa laajennetaan tutkimuskohteita, jotka kuuluvat aktiivisuusmerkittyyn western blottingiin.
tekijän osuudet
M Eto, s Katsuki, y Tanaka ja K Takeya suunnittelivat ja suunnittelivat kokeet. S Katsuki, y Tanaka ja K Takeya suorittivat määritykset. M Eto, s Katsuki, y Tanaka ja K Takeya suorittivat data-analyysin. M Eto, s Katsuki, y Tanaka ja K Takeya kirjoitti paperin.
kiitokset
kirjoittajat haluavat kiittää DL Brautigania käsikirjoituksen oikoluvusta ja arvokkaista ehdotuksista.
Financial & competing interests disclosure
tätä työtä tukevat JSPS KAKENHI (JP19K06573 ja JP19H03125) ja Society for Research on Umami Taste, varat Imabarin kaupungilta ja Ehimen prefektuurista sekä lahja H Awagilta. Tekijöillä ei ole muita merkityksellisiä kytköksiä tai taloudellista osallisuutta mihinkään organisaatioon tai yhteisöön, jolla on taloudellista etua tai taloudellista ristiriitaa käsikirjoituksen aiheen tai materiaalin kanssa, lukuun ottamatta niitä, jotka on julkistettu.
tämän käsikirjoituksen laatimisessa ei käytetty kirjoitusapua.
Open access
tämä teos on lisensoitu Attribution – NonCommercial-NoDerivatives 4.0-Muokkaamattomalla lisenssillä. Jos haluat nähdä kopion tästä lisenssistä, vieraile sivustolla http://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. Hornbeck PV, Zhang B, Murray B ym. PhosphoSitePlus, 2014: mutations, PTMs and recalibrations. Nucleic Acids Res. 43, D512–D520 (2015).Crossref, Medline, CAS, Google Scholar
- 2. Celenza JL, Carlson M. Proteiinikinaasiaktiivisuuden Renaturation on protein blots. Menetelmät Entsymoli. Academic Press, Cambridge Massachusetts, 34, 423-430 (1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. Kalsium-/kalmoduliiniriippuvaisen proteiinikinaasiaktiivisuuden renaturointi elektroforeettisen siirtymisen jälkeen natriumdodekyylisulfaatti-polyakryyliamidigeeleistä kalvoille. Anaali. Biochem. 211(1), 131–138 (1993).Crossref, Medline, CAS, Google Scholar
- 6. Macdonald JA, Borman MA, Muranyi A et al. Endogeenisen sileän lihaksen myosiinifosfataasiin liittyvän kinaasin tunnistaminen. Proc. Natl Acad. Sci. Yhdysvallat 98(5), 2419-2424 (2001).Crossref, Medline, CAS, Google Scholar
- 7. Wooten MW. In-gel-kinaasimääritys menetelmänä kinaasisubstraattien tunnistamiseksi. Sci. STKE 2002 (153), pl15 (2002).Medline, Google Scholar
- 8. Celenza J, Carlson M. glukoosin tukahduttamisesta vapautumisen kannalta välttämätön hiivageeni koodaa proteiinikinaasia. Tiede 233(4769), 1175-1180 (1986).Crossref, Medline, CAS, Google Scholar
- 9. Eto M, Karginov A, Brautigan DL. Proteiinityypin 1 fosfataasin holoentsyymien Uusi fosfoproteiinin estäjä. Biokemia 38(51), 16952-16957 (1999).Crossref, Medline, CAS, Google Scholar
- 10. Macdonald JA, Eto M, Borman MA et al. Myosiinifosfataasin estäjän CPI-17: n kaksois-Ser-ja Thr-fosforylaatio MYPT: hen liittyvän kinaasin vaikutuksesta. FEBS Lett. 493(2–3), 91–94 (2001).Crossref, Medline, CAS, Google Scholar
- 11. Eto M, Leach C, Tountas NA et al. Proteiinifosfataasi-1: n fosfoproteiininestäjät. Menetelmät Entsymoli. 366, 243–260 (2003).Medline, CAS, Google Scholar
- 12. Rousell J, Haddad El B, Lindsay MA et al. M2-muskariinireseptorigeenin säätely trombosyyttipohjaisen kasvutekijän avulla: solunulkoisten signaalia säätelevien proteiinikinaasien osallistuminen alasäätelyprosessiin. Mol. Pharmacol. 52(6), 966–973 (1997).Crossref, Medline, CAS, Google Scholar