akumulační důkazy naznačují, že narušení signalizace fosforylace / defosforylace je spojeno s patologickým chováním buněk. Projekty fosfoproteomu identifikovaly téměř 300 000 fosforylovaných zbytků ser/Thr / Tyr v buněčných proteinech . Souběžně projekt lidského genomu odhalil přibližně 500 proteinových kináz. Přesto bylo každému místu fosforylace přiděleno omezené množství proteinkináz.
in-gel fosforylační test byl vhodnou metodou pro detekci aktivity proteinkinázy ve vzorcích solubilizovaných SDS. Tato metoda byla použita pro identifikaci CaMKII, MYPT1-K (nebo ZIPK) a dalších . V této zkoušce protokol, protein kinázy jsou naloženy na SDS-polyakrylamidovém gelu s vestavěnými substrát polypeptid, a potom se podrobí renaturation, fosforylace pomocí radioaktivního ATP, následuje autoradiografie detekovat hladinu fosforylovaného substrátu. Kromě toho byla detekována autofosforylace kináz na membráně nitrocelulózy nebo polyvinylidenfluoridu (PVDF) za použití radioaktivního ATP . Radioaktivní materiál může být pro uživatele omezením kvůli bezpečnostním předpisům. Autoradiogramy fosforylovaných proteinů navíc postrádají informace o fosforylačních místech.
zde jsme optimalizovali neradioaktivní alternativní test k tradičnímu fosforylačnímu testu v gelu. Jménem kinázy-tagged western blotting (KAT-WB), úspěšně detekuje Tyr-kinázy, které autophosphorylate sami, stejně jako Ser/Thr-kinázy, které fosforylují substrátem proteinu zájmu v konkrétním místě pomocí fosfo (P)-specifické protilátky.
Obrázek 1 ukazuje údaje KAT-WB pro test Autofosforylace Tyr-kinázy. Aby se duplicitní skvrny, dva alikvotní podíl extraktu byly naloženy na SDS polyakrylamidovém gelu, podroben elektroforéze a pak bílkoviny byly převedeny na list z PVDF membrána (0,2 µm). Membrána byla postupně ošetřena pufrovaným 2-propanolem, 6,0 M hydrochloridem guanidinu (Gu-HCl), 3,0 M Gu-HCl, 0,1 M Gu-HCl a renaturačním pufrem(viz doplňkový protokol). Po nočním renaturačním kroku při 4°C byla membrána podélně řezána, aby se vytvořily dva duplicitní kusy (Obrázek 1). Jeden kus membrány byl inkubován po dobu 60 minut s 1 mM MgATP. Druhý kus membrány byl inkubován bez mgatp, jako kontrola. Oba listy byly současně podrobeny imunodetekci protilátkou anti-P-Tyr (klon PY20 při ředění 1:5000). Jak je znázorněno na obrázku 1, bylo detekováno více pásem P-Tyr při 100, 70, 45 a 35 kDa v kontrolní membráně (vlevo nahoře). Tyto P-Tyr proteiny byly pravděpodobně již fosforylovány před extrakcí. Inkubace s MgATP po oddělení zvýšené Tyr fosforylace proteinu na 45 kDa v srdečním svalu lyzáty (Obrázek 1, vpravo nahoře, lane 2), což naznačuje, autophosphorylation Tyr zbytků v této kinázy na membránu následující renaturation. Obrázek 1 ukazuje denzitogramy pruhu 2 (- /+ MgATP). Pro ověření ekvivalentního zatížení proteinu na obou blotech byly filtry podrobeny barvení Coomassie (Obrázek 1, dole). Technická poznámka je, že v průběhu vývoje metody, zjistili jsme, že ošetření s pufrovaného 2-propanol a 6M Gu-HCl byly nezbytné pro detekci aktivity kinázy. Proto kat-WB detekoval 45-kDa Tyr kinázu.

celkové proteiny myších kosterních svalů (31 µg), srdečního svalu (28 µg) a buněk Neuro2a (27 µg) byly podrobeny kat-western blotování. Po renaturaci byla membrána podélně rozřezána na dvě a každá část byla inkubována po dobu 60 minut při 37°C v nepřítomnosti (vlevo) nebo přítomnosti (vpravo) 1 mM ATP. Tyr-fosforylace byla detekována konvenční elektrochemiluminiscenční metodou s použitím anti-P-Tyr protilátky (top). Po imunoblotování byly celkové proteiny na každé skvrně vizualizovány barvením Coomassie (dole). Čísla vpravo označují molekulovou hmotnost markerových proteinů (v kDa). Rámeček vpravo označuje denzitogramy pruhu 2 v levém a pravém panelu. Úrovně jasu a kontrastu blotů jsou totožné.
Další verze KAT-WB používá site-specifické fosforylace substrátu protein vstřebává na PVDF membránu v blízkosti kinázy. Použili jsme fosfatázy holoenzyme inhibitor-1 (PHI-1) jako protein zájmu, jehož fosforylace na Thr57 převádí tento buněčný protein inhibitor typ 1 Ser/Thr fosfatázy . Obrázek 2A ukazuje, KAT-WB dat pomocí jako pozitivní kontrola rekombinantní ZIPK, Ser/Thr kinázy známo, že fosforylují rekombinantní PHI-1 na Thr57 . Po denaturaci a postupně renaturation proces, membrány, bylo namočené přes noc ve 4°C v renaturation tlumivý roztok s rekombinantní PHI-1 divokého typu (WT), nebo nonphosphorylatable verze (T57H) na 0,2 mg/ml, a pak fosforylace reakce byla běh s MgATP. Fosforylovaný PHI-1 na membráně byl detekován pomocí anti-P-PHI-1 (Thr57) protilátky , což odhalilo pásmo rekombinantního ZIPK. Na řídicích membránách byl však detekován pouze slabý signál bez PHI-1 nebo s verzí PHI-1 T57H. Tyto údaje naznačují, že renaturované kinázy na membráně jsou schopny fosforylovat substráty, které jsou také absorbovány na membránu. KAT-WB byl aplikován k detekci více kináz PHI-1 v tkáních a buňkách (obrázek 2B). Extrakty z krysích kosterních, srdečních svalů a buněk Neuro2a byly podrobeny testu KAT-WB. Ve srovnání s ne-ATP ovládání (vlevo, nahoře), signály P-PHI-1 objevil na blot inkubovány s 1 mM MgATP (vpravo, nahoře). Prominentní pásy P-PHI-1 byly detekovány v buněčných Lyzátech Neuro2a při 100, 60 a 49 kDa (pruh 3, otevřená šipka). V pruhu s extrakty kosterních a srdečních svalů (pruhy 1 a 2)však nebyly patrné žádné pásy pro P-PHI-1. Signál P-PHI-1 nebyl zesílen fosforylačním krokem bez PHI-1 (Obrázek 2, dole, prázdný: BLK). Tyto výsledky ukazují, že existuje více kináz PHI-1 exprimovaných v neuronálních buňkách, ale ne v kosterních nebo srdečních svalech. To nám poskytuje výkonný nástroj pro detekci více kináz specifických pro substrát v buňkách a tkáních. Technická poznámka je, že přes noc renaturation s PHI-1 bylo nutné pro detekci fosforylace signály, a že vyšší koncentrace PHI-1 nevedla ke zvýšení intenzity barvení (není zobrazeno).
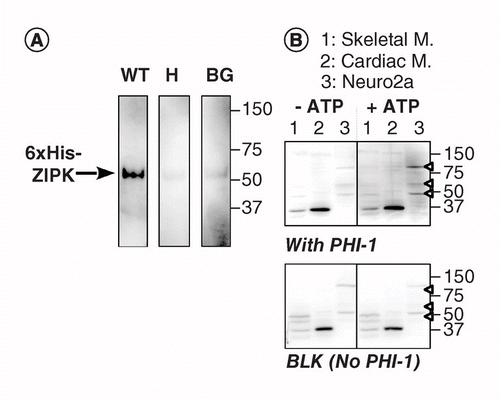
(A) Trojím vyhotovení skvrny byly připraveny pomocí rekombinantní ZIPK částečně očištěn od lyzáty z buněk exprimujících 6× His-tagged verze. Po electroblotting a denaturace–renaturation proces, membrána byla inkubována přes noc s rekombinantní PHI-1 proteinů (WT: left; T57H: center) na 0,2 mg/ml nebo bez FÍ-1 (BG). Každá membrána byla poté inkubována s 1 mM ATP při 37°C a podrobena imunodetekci pomocí anti-P-PHI-1 (T57) protilátky. (B) dvě duplicitní bloty (horní a dolní) byly připraveny za použití celkových vzorků proteinů, jak je popsáno na obrázku 1. Rekombinantní PHI-1 (0, 2 mg / ml) byl přidán do renaturačního pufru pro blot (top). BLK indikuje blot bez rekombinantní léčby PHI-1. Po inkubaci v nepřítomnosti (vlevo) a přítomnosti (vpravo) 1 mM ATP byly bloty podrobeny imunodetekci pomocí anti-P-PHI-1 (Thr57). Šipky vpravo označují umístění P-PHI-1 v pravém horním panelu. Úrovně jasu a kontrastu blotů jsou totožné.
BG: pozadí; WT: divoký typ.
na Základě těchto údajů, můžeme navrhnout, že KAT-WB je schopen detekovat autophosphorylation Tyr kinázy a site-specifické fosforylace selektivní substrát bílkoviny zájmu o více proteinových kináz přítomné v tkáních a buňkách. KAT-WB v podstatě sdílí výhody tradičního v-gel fosforylace test, který detekuje kinázy činnosti v surové směsi, jako jsou buněčné extrakty, odhalení jejich molekulární velikosti . Další výhodou těchto dvou testů je, že post-translační modifikací (PTMs) kináz v buňkách může být zachována v požadovaném čase za určitých podmínek, protože vzorky pro tyto testy jsou rychle denaturované, s vyrovnávací paměti, včetně SDS, což eliminuje fosforylace a dephosphorylation v extraktech . Většina proteinových kináz je regulována pomocí PTM. KAT-WB je schopen sledovat fluktuace v aktivitách kinázy, i když regulační PTM ještě nebyly charakterizovány. KAT-WB není schopen detekovat každou kinázu v buněčných extraktech, protože pouze monomerní enzymy, které účinně renaturují za použitých podmínek, vykazují aktivitu. Modifikace KAT-WB by však měly být schopny detekovat kinázy regulované kalmodulinem a cykliny, jak to bylo provedeno fosforylačním testem v gelu . Zlepšení účinnosti renaturace a kombinace s imunoprecipitací/imunodeplecí protilátkami na kinázy může rozšířit užitečnost tohoto přístupu.
je pozoruhodné, že, kromě fosforylace, princip KAT-WB protokolu může být použita pro detekci jiných PTM enzymy, jako acetylases, methylases a ubiquitin ligázy, když PTM-specifických protilátek jsou k dispozici. Spolu s vývojem protilátek, které rozpoznávají místně specifické PTM, výzkumné cíle, na které se vztahuje západní blotování označené aktivitou, budou rozšířeny.
Autor příspěvků
M Eto, S Katsuki, Tanaka Y a K Takeya koncipován a navržen tak, experimenty. S Katsuki, Y Tanaka a K Takeya provedli testy. M Eto, S Katsuki, Y Tanaka a K Takeya provedli analýzu dat. M Eto, S Katsuki, Y Tanaka a K Takeya napsali noviny.
poděkování
autoři by rádi poděkovali DL Brautiganovi za korekturu rukopisu a za cenné návrhy.
Finanční & konkurenční zájmy zveřejnění
Tato práce je podporována JSP KAKENHI (JP19K06573 a JP19H03125) a Společnosti pro Výzkum Umami Chuť, finanční prostředky z Imabari město a prefektura Ehime, a dar od H Awagi. Autoři nemají žádné další relevantní příslušnost nebo finanční zapojení s jakoukoli organizaci nebo subjekt s finanční zájem nebo finanční rozporu s předmětem či materiály projednány v rukopisu kromě těch zveřejněny.
při výrobě tohoto rukopisu nebyla použita žádná pomoc při psaní.
otevřený přístup
tato práce je licencována pod licencí Attribution-NonCommercial-NoDerivatives 4.0 Unported. Chcete-li zobrazit kopii této licence, navštivte http://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. Hornbeck PV, Zhang B, Murray B et al. PhosphoSitePlus, 2014: mutace, PTMs a rekalibrace. Nukleové Kyseliny Res.43, D512–D520 (2015).Crossref, Medline, CAS, Google Scholar
- 2. Celenza JL, Carlson m. renaturace aktivity proteinkinázy na proteinových blotech. Metody Enzymol. Academic Press, Cambridge Massachusetts, 34, 423-430 (1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. Renaturation kalcium/kalmodulin-dependentní protein kinázy po elektroforetické transfer z sodium dodecyl sulfát-polyakrylamidové gely na membrány. Anální. Biochem. 211(1), 131–138 (1993).Crossref, Medline, CAS, Google Scholar
- 6. Macdonald JA, Borman MA, Muranyi A et al. Identifikace endogenní kinázy spojené s myosin fosfatázou hladkého svalstva. Proc. Natl Acad. Věda. USA 98(5), 2419-2424 (2001).Crossref, Medline, CAS, Google Scholar
- 7. Wooten MW. In-gel kinázový test jako metoda identifikace substrátů kinázy. Věda. STKE 2002 (153), pl15 (2002).Medline, Google Scholar
- 8. Celenza J, Carlson m. kvasinkový gen, který je nezbytný pro uvolnění z represe glukózy, kóduje proteinkinázu. Věda 233(4769), 1175-1180 (1986).Crossref, Medline, CAS, Google Scholar
- 9. Eto M, Karginov A, Brautigan DL. Nový inhibitor fosfoproteinu holoenzymů proteinu typu 1 fosfatázy. Biochemie 38(51), 16952-16957 (1999).Crossref, Medline, CAS, Google Scholar
- 10. Macdonald JA, Eto M, Borman MA et al. Duální ser a Thr fosforylace CPI-17, inhibitoru myosin fosfatázy, kinázou asociovanou s MYPT. FEBS Lett. 493(2–3), 91–94 (2001).Crossref, Medline, CAS, Google Scholar
- 11. Eto M, Leach C, Tountas NA et al. Inhibitory fosfoproteinu proteinové fosfatázy-1. Metody Enzymol. 366, 243–260 (2003).Medline, CAS, Google Scholar
- 12. Rousell J, Haddad El B, Lindsay MA et al. Regulace exprese genu pro muskarinový receptor m2 pomocí růstového faktoru odvozeného od destiček: zapojení extracelulárních signálně regulovaných proteinkináz do procesu down-regulace. Molo. Farmakol. 52(6), 966–973 (1997).Crossref, Medline, CAS, Google Scholar