akkumulerende beviser tyder på, at forstyrrelser i phosphorylering/dephosphoryleringssignalering er forbundet med patologisk opførsel af celler. Fosfoproteomprojekter har identificeret næsten 300.000 phosphorylerede Ser/Thr/Tyr-rester i cellulære proteiner . Parallelt afdækkede human genome project cirka 500 proteinkinaser. Alligevel er der tildelt et begrænset antal proteinkinaser til hvert phosphoryleringssted.
fosforyleringsassayet i gel har været en bekvem metode til påvisning af proteinkinaseaktiviteter i prøver, der er opløst med SDS. Denne metode blev anvendt til identifikation af CaMKII, MYPT1-K (eller lynlås) og andre . I denne analyseprotokol indlæses proteinkinaser på en SDS-polyacrylamidgel indlejret med et substratpolypeptid og underkastes derefter renaturering, phosphorylering under anvendelse af radioaktiv ATP efterfulgt af autoradiografi for at detektere phosphoryleret substrat. Derudover er autophosphorylering af kinaser blevet påvist på nitrocellulose eller POLYVINYLIDENFLUORID (PVDF) membran under anvendelse af radioaktiv ATP . Det radioaktive materiale kan være en begrænsning for brugerne på grund af sikkerhedsforskrifter. Derudover mangler autoradiogrammer af phosphorylerede proteiner nogen information om phosphoryleringssteder.
her optimerede vi et ikke-radioaktivt alternativt assay til det traditionelle fosforyleringsassay i gel. Navngivet kinaseaktivitetsmærket vestlig blotting (KAT-VB), dette registrerer med succes Tyr-kinaser, der autophosphorylerer sig selv såvel som Ser/Thr-kinaser, der phosphorylerer et substratprotein af interesse på et specifikt sted ved hjælp af phospho (P)-specifikke antistoffer.
Figur 1 viser KAT-VB-data for Tyr-kinase autophosphoryleringsassay. For at fremstille duplikatblotter blev to alikvoter af et ekstrakt indlæst på en SDS-polyacrylamidgel, underkastet elektroforese, og derefter blev proteiner overført til et ark PVDF-membran (0,2 liter). Membranen blev sekventielt behandlet med bufret 2-propanol, 6,0 M guanidinhydrochlorid (Gu-HCl), 3,0 M Gu-HCl, 0,1 M Gu-HCl og renatureringsbuffer (se supplerende protokol). Efter et renatureringstrin natten over ved 4 liter C blev membranen skåret i længderetningen for at generere to duplikatstykker (Figur 1). Et stykke membran blev inkuberet i 60 minutter med 1 mM mgatp. Det andet stykke membran blev inkuberet uden MgATP som kontrol. Begge ark blev samtidig udsat for immunodetektion med anti-P-Tyr-antistof (klon PY20 ved 1:5000 fortynding). Som vist i Figur 1 blev flere p-Tyr-bånd detekteret ved 100, 70, 45 og 35 kDa i kontrolmembranen (øverst til venstre). Disse p-Tyr-proteiner blev formodentlig allerede phosphoryleret før ekstraktion. Inkubationen med MgATP efter separation forhøjede Tyr-phosphorylering af et protein ved 45 kDa i hjertemuskellysater (Figur 1, øverst til højre, bane 2), hvilket indikerer autophosphorylering af Tyrrester i denne kinase på membranen efter renaturering. Figur 1 viser densitogrammer af Bane 2 (-/+ MgATP). For at verificere ækvivalent belastning af protein på de to blots blev filtrene udsat for Coomassie-farvning (Figur 1, bund). En teknisk note er, at vi i løbet af udviklingen af metoden fandt, at behandlingerne med bufret 2-propanol og 6M Gu-HCl begge var nødvendige til påvisning af kinaseaktiviteter. Derfor detekterede KAT-VB en 45-kDa Tyr-kinase.

samlede proteiner fra musens skeletmuskulatur (31 liter), hjertemuskulatur (28 liter) og Neuro2a-celler (27 liter) blev udsat for kat-vestlig blotting. Efter renaturering blev membranen skåret i længderetningen i to, og hver del blev inkuberet i 60 minutter ved 37 liter C i fravær (venstre) eller tilstedeværelse (højre) af 1 mM ATP. Tyr-phosphorylering blev påvist ved en konventionel elektrokemiluminescerende metode under anvendelse af anti-P-Tyr-antistof (top). Efter immunoblotting blev totale proteiner på hver plet visualiseret ved Coomassie-farvning (bund). Tal til højre angiver molekylvægt af markørproteiner (i kDa). En boks til højre angiver densitogrammer af Bane 2 i venstre og højre paneler. Niveauer af lysstyrke og kontrast af blots er identiske.
en anden version af KAT-VB bruger stedsspecifik phosphorylering af et substratprotein absorberet på PVDF-membran i nærheden af kinasen. PHI-1 (PHI-1) som et protein af interesse, hvis phosphorylering ved Thr57 omdanner dette cellulære protein til en hæmmer af type-1 Ser/Thr phosphatase . Figur 2a viser KAT-VB-data ved anvendelse af en Ser/Thr-kinase, der er kendt for at phosphorylere rekombinant PHI-1 ved Thr57, som en positiv kontrolrekombinant . Efter denatureringen og den trinvise renatureringsproces blev membranen gennemvædet natten over ved 4 liter C i renatureringsbufferen suppleret med rekombinant PHI-1 vildtype (vægt) eller en ikke-fosforylerbar version (T57H) ved 0,2 mg/ml, og derefter blev phosphoryleringsreaktionen kørt med mgatp. Phosphoryleret PHI-1 på membranen blev påvist under anvendelse af anti-P-PHI-1 (Thr57) antistof , og dette afslørede et bånd af den rekombinante SIPK. Imidlertid blev der kun detekteret et svagt signal på kontrolmembranerne uden PHI-1 eller med T57H-versionen af PHI-1. Disse data antyder, at renaturerede kinaser på membranen er i stand til at phosphorylere substrater, der også absorberes på membranen. KAT-VB blev anvendt til at detektere flere PHI-1-kinaser i væv og celler (figur 2b). Ekstrakter fra rotteskelet, hjertemuskler og Neuro2a-celler blev underkastet KAT-VB-analyse. Sammenlignet med No-ATP-kontrol (venstre, top) optrådte signaler af P-PHI-1 på blottet inkuberet med 1 mM MgATP (højre, top). Fremtrædende bånd af P-PHI-1 blev påvist i Neuro2a-cellelysater ved 100, 60 og 49 kDa (Bane 3, Åben pilespids). Imidlertid var der ingen bånd til P-PHI-1 i banen med ekstrakter af skelet-og hjertemuskler (Bane 1 og 2). P-PHI-1-signalet blev ikke forstærket af phosphoryleringstrinnet uden PHI-1 (Figur 2, bund, blank: BLK). Disse resultater viser, at der er flere PHI-1-kinaser udtrykt i neuronale celler, men ikke i skelet-eller hjertemuskler. Dette giver os et kraftfuldt værktøj til at detektere flere substratspecifikke kinaser i celler og væv. En teknisk note er, at renatureringen natten over med PHI-1 var nødvendig til påvisning af phosphoryleringssignalerne, og at en højere koncentration af PHI-1 ikke øgede farvningsintensiteten (ikke vist).
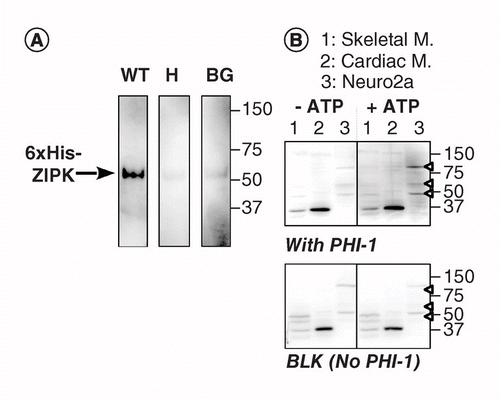
(a) Triplikatblotter blev fremstillet ved anvendelse af rekombinant lynlås delvist oprenset fra lysater af celler, der udtrykte en 6-Karr His-tagget version. Efter elektroblotting og denaturerings–renatureringsprocessen blev membranen inkuberet natten over med rekombinante PHI-1-proteiner (vægt: venstre; T57H: center) ved 0,2 mg/ml eller uden PHI-1 (BG). Hver membran blev derefter inkuberet med 1 mM ATP ved 37 liter C og underkastet immunodetektion under anvendelse af anti-P-PHI-1 (T57) antistof. B) to dublerede blots (top og bund) blev fremstillet ved anvendelse af samlede proteinprøver som beskrevet i Figur 1. Rekombinant PHI-1 (0,2 mg/ml) blev tilsat til renatureringsbufferen for en blot (top). BLK indikerer blot uden den rekombinante PHI-1-behandling. Efter inkubation i fravær (venstre) og tilstedeværelse (højre) af 1 mM ATP blev blotterne underkastet immunodetektion under anvendelse af anti-P-PHI-1 (Thr57). Pilespidser til højre angiver placeringen af P-PHI-1 i øverste højre panel. Niveauer af lysstyrke og kontrast af blots er identiske.
BG: baggrund; vægt: vildtype.
baseret på disse data foreslår vi, at KAT-VB er i stand til at detektere autophosphorylering af Tyr-kinaser og stedsspecifik phosphorylering af selektive substratproteiner af interesse af flere proteinkinaser, der er til stede i væv og celler. KAT-VB deler i det væsentlige fordelene ved det traditionelle fosforyleringsassay i gel, som detekterer kinaseaktiviteter i en rå blanding, såsom celleekstrakter, der udsætter deres molekylære størrelser . En anden fordel ved disse to analyser er, at posttranslationelle modifikationer (PTM ‘ er) af kinaser i celler kan bevares på et ønsket tidspunkt under specifikke betingelser, fordi prøverne til disse analyser hurtigt denatureres med bufferen, inklusive SDS, hvilket eliminerer phosphorylering og dephosphorylering i ekstrakterne . De fleste proteinkinaser reguleres gennem PTM. KAT-VB er i stand til at overvåge udsving i kinaseaktiviteter, selvom regulatoriske PTM ‘ er endnu ikke er karakteriseret. KAT-VB er ikke i stand til at detektere hver kinase i celleekstrakter, fordi kun monomere, der renaturerer effektivt under de anvendte betingelser, viser aktivitet. Imidlertid bør ændringer af KAT-VB være i stand til at detektere kinaser reguleret af calmodulin og cycliner, som det er gjort ved in-gel phosphoryleringsassay . Forbedring af renatureringseffektivitet og en kombination med immunudfældning/immunodepletion med antistoffer mod kinaser kan udvide anvendeligheden af fremgangsmåden.
det er bemærkelsesværdigt, at ud over fosforylering kan princippet om kat-VB-protokol anvendes til påvisning af andre PTM-antistoffer, såsom acetylaser, methylaser og allestedsnærværende ligaser, når PTM-specifikke antistoffer er tilgængelige. Sammen med udviklingen af antistoffer, der genkender stedsspecifikke PTM ‘ er, forskningsmål dækket af aktivitetsmærket vestlig blotting vil blive udvidet.
Forfatterbidrag
M Eto, s Katsuki, y Tanaka og K Takeya udtænkte og designede eksperimenterne. S Katsuki, y Tanaka og K Takeya gennemførte analyserne. M Eto, s Katsuki, y Tanaka og K Takeya udførte dataanalysen. M Eto, s Katsuki, y Tanaka og K Takeya skrev papiret.
anerkendelser
forfatterne vil gerne takke dl Brautigan for korrekturlæsning af manuskriptet og for værdifulde forslag.
finansiel & offentliggørelse af konkurrerende interesser
dette arbejde understøttes af JSPS KAKENHI (JP19K06573 og JP19H03125) og Society for Research on Umami Taste, midler fra Imabari city og Ehime prefecture og en gave fra H Aagi. Forfatterne har ingen andre relevante tilknytninger eller økonomisk involvering med nogen organisation eller enhed med en økonomisk interesse i eller økonomisk konflikt med det emne eller materiale, der er diskuteret i manuskriptet bortset fra dem, der er beskrevet.
ingen skriftlig bistand blev anvendt i produktionen af dette manuskript.
Open access
dette værk er licenseret under Attribution-NonCommercial-NoDerivatives 4.0 Unported License. For at se en kopi af denne licens, besøg http://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. Hornbeck PV, Jang B, Murray B et al. PhosphoSitePlus, 2014: mutationer, PTM ‘ er og rekalibreringer. Nukleinsyrer Res. 43, D512-D520 (2015).Crossref, Medline, CAS, Google Scholar
- 2. Renaturering af proteinkinaseaktivitet på proteinblots. Metoder. Akademisk Presse, Cambridge Massachusetts, 34, 423-430 (1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. Renaturering af calcium / calmodulinafhængig proteinkinaseaktivitet efter elektroforetisk overførsel fra natriumdodecylsulfat-polyacrylamidgeler til membraner. Anal. Biochem. 211(1), 131–138 (1993).Crossref, Medline, CAS, Google Scholar
- 6. Macdonald JA, Borman MA, Muranyi A et al. Identifikation af den endogene glatte muskel myosinphosphatase-associerede kinase. Proc. Natl Acad. Sci. USA 98(5), 2419-2424 (2001).Crossref, Medline, CAS, Google Scholar
- 7. Jørgen Jørgensen. In-gel kinase assay som en metode til identifikation af kinasesubstrater. Sci. STKE 2002 (153), pl15 (2002).Medline, Google Scholar
- 8. Et gærgen, der er essentielt for frigivelse fra glukoseundertrykkelse, koder for en proteinkinase. Videnskab 233(4769), 1175-1180 (1986).Crossref, Medline, CAS, Google Scholar
- 9. Eto M, Karginov A, Brautigan DL. En ny phosphoproteininhibitor af protein type-1 phosphatase. Biokemi 38(51), 16952-16957 (1999).Crossref, Medline, CAS, Google Scholar
- 10. Macdonald JA, Eto M, Borman MA et al. Dual Ser og Thr phosphorylering af CPI-17, en hæmmer af myosinphosphatase, ved MYPT-associeret kinase. FEBS Lett. 493(2–3), 91–94 (2001).Crossref, Medline, CAS, Google Scholar
- 11. Eto M, udvaskning C, Tountas NA et al. Phosphoproteinhæmmere af proteinphosphatase-1. Metoder. 366, 243–260 (2003).Medline, CAS, Google Scholar
- 12. Rousell J, Haddad El B, Lindsay MA et al. Regulering af M2 muskarinreceptorgenekspression med blodpladeafledt vækstfaktor: involvering af ekstracellulære signalregulerede proteinkinaser i nedreguleringsprocessen. Mol. Pharmacol. 52(6), 966–973 (1997).Crossref, Medline, CAS, Google Scholar