Akkumulerende bevis tyder på at forstyrrelser i fosforylering/defosforyleringssignalering er forbundet med patologisk oppførsel av celler. Fosfo-proteom-prosjekter har identifisert nesten 300,000 fosforylerte Ser / Thr / Tyr-rester i cellulære proteiner . Parallelt avdekket human genome project omtrent 500 proteinkinaser. Likevel har et begrenset antall proteinkinaser blitt tildelt hvert fosforyleringssted.
in-gel fosforyleringsanalysen har vært en praktisk metode for å oppdage proteinkinaseaktiviteter i prøver som er oppløselige med SDS. Denne metoden ble brukt for identifisering Av CaMKII, MYPT1-K (ELLER ZIPK) og andre . I denne analyseprotokollen lastes proteinkinaser på EN sds-polyakrylamidgel innebygd med et substratpolypeptid, og underkastes deretter renaturering, fosforylering ved bruk av radioaktivt ATP, etterfulgt av autoradiografi for å oppdage fosforylert substrat. I tillegg har autofosforylering av kinaser blitt påvist på nitrocellulose eller polyvinylidenfluorid (PVDF) membran ved bruk av radioaktivt ATP . Det radioaktive materialet kan være en begrensning for brukere, på grunn av sikkerhetsforskrifter. I tillegg mangler autoradiogrammer av fosforylerte proteiner informasjon om fosforyleringssteder.
her optimaliserte vi en ikke-radioaktiv alternativ analyse til den tradisjonelle fosforyleringsanalysen i gel. Kalt kinase activity-tagged western blotting (KAT-WB), oppdager dette vellykket Tyr-kinaser som autofosforylerer seg selv, så Vel som Ser/Thr-kinaser som fosforylerer et substratprotein av interesse på et bestemt sted ved hjelp av fosfo (P)-spesifikke antistoffer.
Figur 1 viser kat-WB-data for Tyr-kinase autofosforyleringsanalyse. For å lage dupliserte blotter ble to alikvoter av et ekstrakt lastet på EN sds polyakrylamidgel, underkastet elektroforese, og deretter ble proteiner overført til ET ARK MED PVDF-membran (0,2 µ). Membranen ble sekvensielt behandlet med bufret 2-propanol, 6,0 m guanidinhydroklorid (Gu-HCl), 3,0 M Gu-HCl, 0,1 M Gu-HCl og renatureringsbuffer (Se Tilleggsprotokoll). Etter et renatureringstrinn over natten ved 4°C ble membranen kuttet i lengderetningen for å generere to dupliserte stykker (Figur 1). Ett stykke membran ble inkubert i 60 min med 1 mM MgATP. Det andre stykket membran ble inkubert uten MgATP, som en kontroll. Begge arkene ble samtidig immundeteksjonert med anti-P-Tyr antistoff (Klon PY20 ved 1: 5000 fortynning). Som vist i Figur 1 ble flere p-Tyr-bånd detektert ved 100, 70, 45 og 35 kDa i kontrollmembranen (øverst til venstre). Disse p-Tyr-proteinene var antagelig allerede fosforylert før ekstraksjon. Inkubasjonen med MgATP etter separasjon økte Tyr-fosforylering av et protein ved 45 kDa i hjertemuskellysater (Figur 1, øverst til høyre, lane 2), noe som indikerer autofosforylering Av tyr-rester i denne kinasen på membranen etter renaturering. Figur 1 viser densitogrammer av lane 2 (- /+ MgATP). For å verifisere ekvivalent lasting av protein på de to blottene, ble filtrene utsatt For Coomassie-farging (Figur 1, bunn). Et teknisk notat er at i løpet av utviklingen av metoden fant vi at behandlingene med bufret 2-propanol OG 6M Gu-HCl begge var nødvendige for påvisning av kinaseaktiviteter. DERFOR oppdaget KAT-WB en 45-kDa Tyr kinase.

totale proteiner i skjelettmuskulatur fra mus (31 µ), hjertemuskulatur (28 µ) og Nevro2a-celler (27 µ) ble utsatt for kat-western blotting. Etter renaturering ble membranen kuttet i lengderetningen i to, og hver del ble inkubert i 60 min ved 37°C i fravær (venstre) eller tilstedeværelse (høyre) AV 1 mM ATP. Tyr-fosforylering ble påvist ved en konvensjonell elektrokjemiluminescerende metode ved bruk av anti-P-Tyr antistoff (top). Etter immunoblotting ble totale proteiner på hver blot visualisert Ved Coomassie-farging (bunn). Tall til høyre indikerer molekylvekt av markørproteiner (i kDa). En boks til høyre angir densitograms av lane 2 i venstre og høyre paneler. Nivåer av lysstyrke og kontrast av blotter er identiske.
En annen versjon av KAT-WB bruker stedsspesifikk fosforylering av et substratprotein absorbert PÅ PVDF-membran i nærheten av kinasen. Vi brukte fosfatase holoenzyme inhibitor – 1 (PHI-1) som et protein av interesse, hvis fosforylering Ved Thr57 omdanner dette cellulære proteinet til en inhibitor av Type-1 Ser/Thr fosfatase . Figur 2a viser kat-WB data ved bruk som en positiv kontroll rekombinant ZIPK, En Ser/Thr kinase kjent for å fosforylere rekombinant PHI-1 Ved Thr57 . Etter denatureringen og den trinnvise renatureringsprosessen ble membranen gjennomvåt over natten ved 4°C i renatureringsbufferen supplert med rekombinant PHI – 1 villtype (WT) eller en ikke-fosforylerbar versjon (T57H) ved 0,2 mg/ml, og deretter ble fosforyleringsreaksjonen kjørt med MgATP. Fosforylert PHI-1 på membranen ble detektert ved bruk av anti-P-PHI-1 (Thr57) antistoff , og dette viste et bånd av rekombinant ZIPK. Imidlertid ble det bare oppdaget et svakt signal på kontrollmembranene uten PHI-1 eller MED t57h-versjonen AV PHI-1. Disse dataene antyder at ommettede kinaser på membranen er i stand til å fosforylere substrater som også absorberes på membranen. KAT-WB ble brukt til å oppdage FLERE PHI-1 kinaser i vev og celler (Figur 2b). Ekstrakter fra rotte skjelett, hjerte muskler og Neuro2a celler ble utsatt FOR KAT-WB assay. Sammenlignet med NO-ATP-kontroll (venstre, topp), oppstod signaler AV P-PHI-1 på blottet inkubert med 1 mM MgATP (høyre, topp). Fremtredende bånd AV P-PHI-1 ble påvist I Nevro2a-cellelysater ved 100, 60 og 49 kDa (lane 3, open arrowhead). Imidlertid var ingen bånd FOR P-PHI-1 tydelig i banen med ekstrakter av skjelett-og hjertemuskulatur (baner 1 og 2). P-PHI-1-signalet ble ikke forbedret av fosforyleringstrinnet uten PHI-1 (Figur 2, bunn, blank: BLK). Disse resultatene viser at DET er flere PHI-1-kinaser uttrykt i nevronceller, men ikke i skjelett-eller hjertemuskulatur. Dette gir oss et kraftig verktøy for å oppdage flere substratspesifikke kinaser i celler og vev. En teknisk merknad er at natten renaturering MED PHI-1 var nødvendig for påvisning av fosforylering signaler, og at en høyere konsentrasjon AV PHI-1 ikke øke fargeintensiteten (ikke vist).
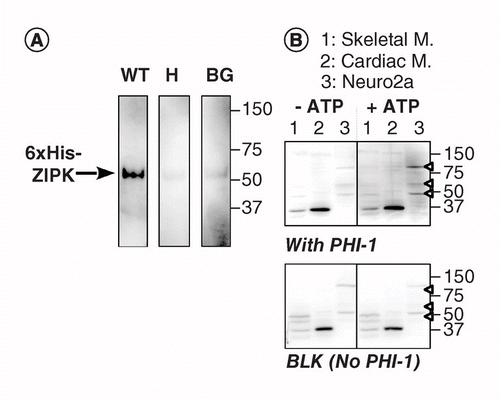
(A) Triplikatblotter ble fremstilt ved bruk av rekombinant ZIPK, delvis renset fra lysater av celler som uttrykte En His-tagget versjon med 6×. Etter elektroblotting og denaturering–renatureringsprosessen ble membranen inkubert over natten med rekombinante PHI – 1-proteiner (wt: venstre; T57H: senter) ved 0,2 mg / ml ELLER UTEN PHI-1 (BG). Hver membran ble deretter inkubert med 1 mM ATP ved 37°C og underkastet immunodeteksjon ved bruk av anti-P-PHI-1 (T57) antistoff. (B) To dupliserte blotter (topp og bunn) ble fremstilt ved hjelp av totale proteinprøver, som beskrevet i Figur 1. Rekombinant PHI-1 (0,2 mg/ml) ble tilsatt til renatureringsbufferen for en blot (topp). BLK indikerer blottet uten rekombinant PHI-1-behandling. Etter inkubasjon i fravær (venstre) og tilstedeværelse (høyre) AV 1 mM ATP ble blottene utsatt for immunodeteksjon ved bruk av anti-P-PHI-1 (Thr57). Pilspisser til høyre angir plasseringen AV P-PHI-1 i øverste høyre panel. Nivåer av lysstyrke og kontrast av blotter er identiske.
BG: Bakgrunn; WT: Wild-type.
Basert på disse dataene foreslår VI AT KAT-WB er i stand til å oppdage autofosforylering Av Tyr-kinaser og stedsspesifikk fosforylering av selektive substratproteiner av interesse ved flere proteinkinaser tilstede i vev og celler. KAT-WB deler i hovedsak fordeler med den tradisjonelle fosforyleringsanalysen i gel, som oppdager kinaseaktiviteter i en rå blanding, for eksempel celleekstrakter, og utsetter deres molekylære størrelser . En annen fordel med disse to analysene er at Post-translasjonelle modifikasjoner (Ptm) av kinaser i celler kan bevares på et ønsket tidspunkt under spesifikke forhold, fordi prøvene for disse analysene raskt denatureres med bufferen, inkludert SDS, eliminerer fosforylering og defosforylering i ekstraktene . De fleste proteinkinaser er regulert GJENNOM PTM. KAT-WB er i stand til å overvåke svingninger i kinaseaktiviteter, selv om regulatoriske Ptmer ennå ikke er karakterisert. KAT-WB kan ikke oppdage hver kinase i celleekstrakter fordi bare monomere enzymer som renaturerer effektivt under de anvendte forholdene, viser aktivitet. Modifikasjoner AV KAT-WB bør imidlertid kunne oppdage kinaser regulert av calmodulin og cyclins, som det har blitt gjort ved in-gel fosforyleringsanalyse . Forbedring av renatureringseffektiviteten og en kombinasjon med immunprecipitasjon / immunodepletion med antistoffer mot kinaser kan utvide nytten av tilnærmingen.
det er bemerkelsesverdig at i tillegg til fosforylering kan prinsippet OM KAT-WB-protokoll brukes til påvisning av ANDRE PTM-enzymer, som acetylaser, metylaser og ubiquitinligaser, NÅR PTM-spesifikke antistoffer er tilgjengelige. Sammen med utviklingen av antistoffer som gjenkjenner stedspesifikke Ptm, vil forskningsmål dekket av aktivitetsmerket western blotting bli utvidet.
Forfatterbidrag
M Eto, S Katsuki, Y Tanaka Og K Takeya unnfanget og designet eksperimentene. S Katsuki, Y Tanaka Og K Takeya gjennomførte analysene. M Eto, S Katsuki, Y Tanaka og K Takeya utførte dataanalysen. M Eto, S Katsuki, Y Tanaka og K Takeya skrev avisen.
Bekreftelser
forfatterne vil gjerne takke Dl Brautigan for korrekturlesing av manuskriptet og for verdifulle forslag.
Financial & competing interests disclosure
dette arbeidet er støttet AV JSPS KAKENHI (JP19K06573 OG JP19H03125) Og Society For Research on Umami Taste, midler Fra imabari city Og Ehime prefecture, og en gave fra H Awagi. Forfatterne har ingen andre relevante tilknytninger eller økonomisk engasjement med noen organisasjon eller enhet med økonomisk interesse i eller økonomisk konflikt med emnet eller materialene som er diskutert i manuskriptet, bortsett fra de som er beskrevet.
ingen skriftlig assistanse ble benyttet i produksjonen av dette manuskriptet.
Open access
dette verket er lisensiert Under Lisensen Attribution-NonCommercial-NoDerivatives 4.0 Unported. For å se en kopi av denne lisensen, besøk http://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. Hornbeck PV, Zhang B, Murray B et al. PhosphoSitePlus, 2014: mutasjoner, Ptmer og rekalibreringer. Nukleinsyrer Res. 43, D512–D520 (2015).Crossref, Medline, CAS, Google Scholar
- 2. Celenza JL, Carlson M. Renaturering av proteinkinaseaktivitet på proteinblotter. Metoder Enzymol. Academic Press, Cambridge Massachusetts, 34, 423-430 (1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. Renaturering av kalsium / kalmodulinavhengig proteinkinaseaktivitet etter elektroforetisk overføring fra natriumdodecylsulfat-polyakrylamidgeler til membraner. Anal. Biochem. 211(1), 131–138 (1993).Crossref, Medline, CAS, Google Scholar
- 6. Macdonald JA, Borman MA, Muranyi a et al. Identifikasjon av endogen glatt muskel myosin fosfatase-assosiert kinase. Proc. Natl Acad. Sci. USA 98(5), 2419-2424 (2001).Crossref, Medline, CAS, Google Scholar
- 7. Wooten MW. In-gel kinase assay som en metode for å identifisere kinasesubstrater. Sci. STKE 2002 (153), pl15 (2002).Medline, Google Scholar
- 8. Celenza J, Carlson M. et gjærgen som er avgjørende for frigjøring fra glukose undertrykkelse koder for en proteinkinase. Vitenskap 233(4769), 1175-1180 (1986).Crossref, Medline, CAS, Google Scholar
- 9. Eto M, Karginov A, Brautigan DL. En ny fosfoproteininhibitor av protein type-1 fosfatase holoenzymer. Biokjemi 38(51), 16952-16957 (1999).Crossref, Medline, CAS, Google Scholar
- 10. Macdonald JA, Eto M, Borman MA et al. Dobbel Ser-og Thr-fosforylering AV KPI-17, en hemmer av myosinfosfatase, ved MYPT-assosiert kinase. FEBS Lett. 493(2–3), 91–94 (2001).Crossref, Medline, CAS, Google Scholar
- 11. Eto M, Leach C, Tountas NA ET al. Fosfoproteininhibitorer av proteinfosfatase-1. Metoder Enzymol. 366, 243–260 (2003).Medline, CAS, Google Scholar
- 12. Rousell J, Haddad El B, Lindsay MA et al. Regulering av m2 muskarinreseptorgenuttrykk ved blodplatederivert vekstfaktor: involvering av ekstracellulære signalregulerte proteinkinaser i nedreguleringsprosessen. Mol. Pharmacol. 52(6), 966–973 (1997).Crossref, Medline, CAS, Google Scholar