gromadzenie dowodów sugeruje, że zakłócenia w sygnalizacji fosforylacji/defosforylacji są związane z patologicznymi zachowaniami komórek. Projekty Phospho-proteome zidentyfikowały prawie 300 000 fosforylowanych reszt Ser / Thr / Tyr w białkach komórkowych . Równolegle w ramach projektu ludzkiego genomu odkryto około 500 kinaz białkowych. Jednak ograniczona liczba kinaz białkowych została przypisana do każdego miejsca fosforylacji.
test fosforylacji w żelu był wygodną metodą wykrywania aktywności kinazy białkowej w próbkach rozpuszczonych SDS. Metoda ta została zastosowana do identyfikacji CaMKII, MYPT1-K (lub ZIPK) i innych . W tym protokole testu kinazy białkowe są ładowane na żel poliakrylamidowy SDS osadzony z polipeptydem substratowym, a następnie poddawane renaturacji, fosforylacji przy użyciu radioaktywnego ATP, a następnie autoradiografii w celu wykrycia fosforylowanego substratu. Ponadto wykryto autofosforylację kinaz na błonie nitrocelulozy lub fluorku poliwinylidenu (PVDF) przy użyciu radioaktywnego ATP . Materiał promieniotwórczy może być ograniczeniem dla użytkowników, ze względu na przepisy bezpieczeństwa. Ponadto autoradiogramy fosforylowanych białek nie zawierają żadnych informacji o miejscach fosforylacji.
tutaj zoptymalizowaliśmy nieradioaktywny test alternatywny do tradycyjnego testu fosforylacji w żelu. Nazwany aktywności kinazy western blotting (Kat-WB), to skutecznie wykrywa Tyr-kinazy, które autofosforylują się, jak również Ser/Thr-kinazy, które fosforylują białko substratowe interesujące w określonym miejscu przy użyciu przeciwciał specyficznych dla fosfo (P).
Fig. 1 przedstawia dane KAT-WB dla testu autofosforylacji kinazy Tyr. Aby uzyskać zduplikowane plamy, dwie porcje ekstraktu załadowano na żel poliakrylamidowy SDS, poddano elektroforezie, a następnie białka przeniesiono na arkusz membrany PVDF(0,2 µm). Membranę traktowano kolejno buforowanym 2-propanolem, 6,0 m chlorowodorkiem guanidyny (gu-HCl), 3,0 M gu-HCl, 0,1 m gu-HCl i buforem renaturacji (patrz protokół uzupełniający). Po nocnym etapie renaturacji w temperaturze 4°C, membranę przecięto wzdłuż w celu wytworzenia dwóch duplikatów (ryc. 1). Jeden kawałek membrany inkubowano przez 60 minut z 1 mM MgATP. Drugi fragment membrany inkubowano bez MgATP, jako kontrolny. Oba arkusze poddano jednocześnie immunodetekcji przeciwciałem anty-P-Tyr (klon PY20 w rozcieńczeniu 1:5000). Jak pokazano na fig. 1, wykryto wiele pasm P-Tyr przy 100, 70, 45 i 35 kDa w membranie kontrolnej (lewy górny róg). Te białka P-Tyr prawdopodobnie były już fosforylowane przed ekstrakcją. Inkubacja z MgATP po rozdzieleniu zwiększyła fosforylację Tyr białka przy 45 kDa w lizatach mięśnia sercowego (Fig.1, prawy górny pas 2), co wskazuje na autofosforylację reszt Tyr w tej kinazie na błonie po renaturacji. Rysunek 1 przedstawia densytogramy pasa 2 (- /+MgATP). Aby zweryfikować równoważny ładunek białka na dwóch plamach, filtry poddano barwieniu Coomassie (Fig. 1, dół). Uwaga techniczna jest taka, że w trakcie opracowywania metody stwierdziliśmy, że zabiegi z buforowanym 2-propanolem i 6m gu-HCl były niezbędne do wykrywania aktywności kinazy. Dlatego Kat-WB wykrył kinazę Tyr 45-kDa.

całkowite białka mięśni szkieletowych myszy (31 µg), mięśnia sercowego (28 µg) i komórek Neuro2a (27 µg) poddano Kat-western blotting. Po renaturacji membranę przecięto wzdłuż na dwie części, A każdą część inkubowano przez 60 minut w temperaturze 37°C przy braku (po lewej) lub obecności (po prawej) 1 mM ATP. Tyr-fosforylację wykryto konwencjonalną metodą elektrochemiluminescencyjną przy użyciu przeciwciała anty-P-Tyr (top). Po immunoblottingu całkowite białka na każdej plamie wizualizowano przez barwienie coomassie (bottom). Liczby po prawej wskazują masy cząsteczkowe białek markerowych (w kDa). Pole po prawej stronie wskazuje densytogramy pasa 2 w lewym i prawym panelu. Poziomy jasności i kontrastu plam są identyczne.
inna wersja Kat-WB wykorzystuje site-specific fosforylacji białka substratu absorbowanego na błonie PVDF w pobliżu kinazy. Jako interesujące białko użyliśmy inhibitora holoenzymu fosfatazy-1 (PHI-1), którego fosforylacja w thr57 przekształca to białko komórkowe w inhibitor fosfatazy Ser/Thr typu 1. 2A przedstawia dane KAT-WB wykorzystujące jako pozytywną kontrolę rekombinowany ZIPK, kinazę Ser/Thr znaną z fosforylacji rekombinowanego PHI-1 w thr57 . Po denaturacji i stopniowym procesie renaturacji membranę moczono przez noc w temperaturze 4°c w buforze renaturacji uzupełnionym rekombinowanym typem dzikim PHI-1 (WT) lub wersją niefosforylowalną (T57H) w temperaturze 0,2 mg/ml, a następnie reakcję fosforylacji prowadzono MgATP. Fosforylowane PHI-1 na błonie wykryto przy użyciu przeciwciała anty-P-PHI-1 (Thr57), co ujawniło pasmo rekombinowanego ZIPK. Jednak tylko słaby sygnał został wykryty na membranach sterujących bez PHI-1 lub z wersją T57H PHI-1. Dane te sugerują, że renaturatowane kinazy na błonie są w stanie fosforylować substraty, które są również absorbowane na błonie. Kat-WB zastosowano do wykrywania wielu kinaz PHI-1 w tkankach i komórkach (Fig.2b). Ekstrakty z kości szczura, mięśni serca i komórek Neuro2a poddano testowi Kat-WB. W porównaniu z kontrolą no-ATP (lewy, górny), sygnały P-PHI-1 pojawiły się na plamce inkubowanej z 1 mM MgATP (prawy, górny). Znaczące pasma P-PHI-1 wykryto w lizatach komórek Neuro2a w stężeniu 100, 60 i 49 kDa (pas 3, otwarty grot strzałki). Jednak nie stwierdzono pasm dla P-PHI-1 W pasie z ekstraktami mięśni szkieletowych i sercowych (Pasy 1 i 2). Sygnał P-PHI-1 nie został wzmocniony przez etap fosforylacji bez PHI-1 (Fig. Wyniki te pokazują, że istnieje wiele kinaz PHI – 1 ulegających ekspresji w komórkach neuronalnych, ale nie w mięśniach szkieletowych lub sercowych. Zapewnia nam to potężne narzędzie do wykrywania wielu kinaz specyficznych dla substratów w komórkach i tkankach. Uwaga techniczna jest taka, że nocna renaturacja za pomocą PHI-1 była konieczna do wykrycia sygnałów fosforylacji, a wyższe stężenie PHI-1 nie zwiększało intensywności barwienia (nie pokazano).
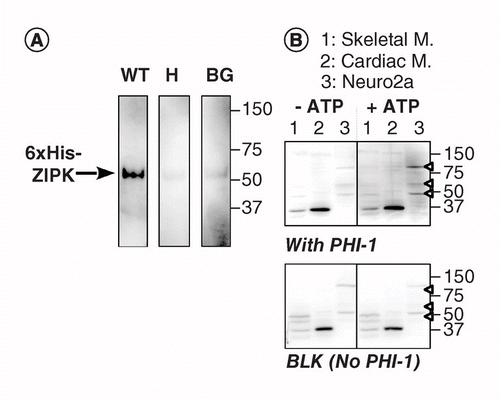
(A) otrzymano potrójne plamy przy użyciu rekombinowanego ZIPK częściowo oczyszczonego z lizatów komórek wyrażających 6-krotną wersję oznaczoną przez His. Po elektroblotacji i procesie denaturacji–renaturacji, błonę inkubowano przez noc z rekombinowanymi białkami PHI-1 (WT: lewy; t57h: środkowy) w dawce 0,2 mg/ml lub bez PHI-1 (BG). Następnie każdą błonę inkubowano z 1 mM ATP w temperaturze 37°C i poddano immunodetekcji z użyciem przeciwciała anty-P-PHI-1 (T57). B) dwa zduplikowane plamy (górny i dolny) zostały przygotowane przy użyciu próbek białek całkowitych, jak opisano na fig.1. Rekombinowany PHI-1 (0,2 mg/ml) dodano do buforu renaturacji w celu uzyskania plamy (top). BLK oznacza plamkę bez leczenia rekombinowanym PHI-1. Po inkubacji w nieobecności (po lewej) i obecności (po prawej) 1 mM ATP, plamy poddano immunodetekcji z użyciem anty-P-PHI-1 (Thr57). Groty strzał po prawej stronie wskazują położenie P-PHI-1 W prawym górnym panelu. Poziomy jasności i kontrastu plam są identyczne.
BG: Background; WT: Wild-type.
na podstawie tych danych proponujemy, że KAT-WB jest zdolny do wykrywania autofosforylacji kinaz Tyr i fosforylacji specyficznych miejsc selektywnych białek substratowych będących przedmiotem zainteresowania przez wiele kinaz białkowych obecnych w tkankach i komórkach. KAT-WB zasadniczo podziela zalety tradycyjnego testu fosforylacji w żelu, który wykrywa aktywność kinazy w surowej mieszaninie, takiej jak ekstrakty komórkowe, odsłaniając ich rozmiary cząsteczkowe . Inną zaletą tych dwóch testów jest to, że potranslacyjne modyfikacje (PTMs) kinaz w komórkach mogą być zachowane w pożądanym punkcie czasowym w określonych warunkach, ponieważ próbki do tych testów są szybko denaturowane buforem, w tym SDS, eliminując fosforylację i defosforylację w ekstraktach . Większość kinaz białkowych jest regulowana przez PTM. KAT-WB jest w stanie monitorować wahania aktywności kinaz, nawet jeśli regulacyjny PTM nie został jeszcze scharakteryzowany. KAT-WB nie jest w stanie wykryć każdej kinazy w ekstraktach komórkowych, ponieważ aktywność wykazują tylko enzymy monomeryczne, które skutecznie ulegają przemianie w zastosowanych warunkach. Jednakże modyfikacje KAT-WB powinny być w stanie wykryć kinazy regulowane przez kalmodulinę i cykliny, tak jak to miało miejsce w teście fosforylacji w żelu . Poprawa wydajności renaturacji i połączenie z immunoprecypitacją/zmniejszeniem odporności z przeciwciałami dla kinaz może rozszerzyć użyteczność tego podejścia.
warto zauważyć, że oprócz fosforylacji, zasada protokołu KAT-WB może być stosowana do wykrywania innych enzymów PTM, takich jak acetylazy, metylazy i ligazy ubikwityny, gdy dostępne są przeciwciała specyficzne dla PTM. Wraz z rozwojem przeciwciał, które rozpoznają specyficzne dla miejsca PTMs, cele badawcze objęte oznaczoną aktywnością western blotting zostaną rozszerzone.
wkład autora
m ETO, s Katsuki, y Tanaka i K Takeya stworzyli i zaprojektowali eksperymenty. Testy przeprowadzili s Katsuki, y Tanaka i K Takeya. M ETO, s Katsuki, y Tanaka i K Takeya przeprowadzili analizę danych. Artykuł napisali m Eto, s Katsuki, y Tanaka i K Takeya.
podziękowania
autorzy pragną podziękować DL Brautiganowi za korektę manuskryptu i cenne sugestie.
finansowe & ujawnienie interesów konkurencyjnych
ta praca jest wspierana przez JSPS KAKENHI (JP19K06573 i JP19H03125) i Society for Research on Umami Taste, fundusze z miasta Imabari i prefektury Ehime oraz prezent od H Awagi. Autorzy nie mają żadnych innych istotnych powiązań ani finansowego zaangażowania z jakąkolwiek organizacją lub podmiotem, którego interes finansowy lub konflikt finansowy dotyczy przedmiotu lub materiałów omawianych w manuskrypcie, poza tymi ujawnionymi.
przy tworzeniu tego rękopisu nie wykorzystano pomocy pisarskiej.
Open access
ta praca jest licencjonowana na licencji Attribution-NonCommercial-NoDerivatives 4.0 Unported License. Aby wyświetlić kopię tej licencji, odwiedź http://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. Hornbeck PV, Zhang B, Murray B et al. PhosphoSitePlus, 2014: mutacje, PTMs i rekalibracje. Nucleic Acids Res. 43, D512–D520 (2015).Crossref, Medline, CAS, Google Scholar
- 2. Celenza JL, Carlson M. Renaturation of protein kinase activity on protein blots. Metody Enzymol. Academic Press, Cambridge Massachusetts, 34, 423-430 (1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. Zmiana aktywności kinazy białkowej zależnej od wapnia / kalmoduliny po elektroforetycznym przeniesieniu z żeli poliakryloamidowych siarczanu dodecylu sodu do błon. Anal. Biochem. 211(1), 131–138 (1993).Crossref, Medline, CAS, Google Scholar
- 6. Macdonald JA, Borman MA, Muranyi A et al. Identyfikacja endogennej kinazy związanej z fosfatazą miozyny mięśni gładkich. Proc. Natl Acad. Sci. USA 98(5), 2419-2424 (2001).Crossref, Medline, CAS, Google Scholar
- 7. Wooten MW. Oznaczenie kinazy w żelu jako sposób identyfikacji substratów kinazy. Sci. STKE 2002 (153), pl15 (2002).Medline, Google Scholar
- 8. Celenza J, Carlson M. Gen drożdżowy niezbędny do uwolnienia z represji glukozy koduje kinazę białkową. Nauka 233(4769), 1175-1180 (1986).Crossref, Medline, CAS, Google Scholar
- 9. Eto M, Karginov a, Brautigan DL. Nowy inhibitor fosfoprotein holoenzymów fosfatazy białkowej typu 1. Biochemia 38(51), 16952-16957 (1999).Crossref, Medline, CAS, Google Scholar
- 10. Macdonald JA, Eto M, Borman MA et al. Podwójna fosforylacja Ser i Thr CPI-17, inhibitora fosfatazy miozyny, przez kinazę związaną z MYPT. FEBS Lett. 493(2–3), 91–94 (2001).Crossref, Medline, CAS, Google Scholar
- 11. Eto M, Leach C, Tountas NA et al. Inhibitory fosfoprotein fosfatazy białkowej-1. Metody Enzymol. 366, 243–260 (2003).Medline, CAS, Google Scholar
- 12. Rousell J, Haddad El B, Lindsay MA et al. Regulacja ekspresji genów receptora muskarynowego M2 przez płytkowy czynnik wzrostu: udział zewnątrzkomórkowych kinaz białkowych regulowanych sygnałem w procesie down-regulacyjnym. Mol. Pharmacol. 52(6), 966–973 (1997).Crossref, Medline, CAS, Google Scholar