蓄積の証拠は、リン酸化/脱リン酸化シグナル伝達の混乱が細胞の病理学的行動に関連していることを示唆している。 ホスホプロテオームプロジェクトは、細胞タンパク質中のほぼ300,000リン酸化されたSer/Thr/Tyr残基を同定している。 並行して、ヒトゲノムプロジェクトは約500のプロテインキナーゼを発見した。 しかし、限られた数のプロテインキナーゼが各リン酸化部位に割り当てられている。
ゲル内リン酸化アッセイは、SDSで可溶化されたサンプル中のプロテインキナーゼ活性を検出するための便利な方法でした。 この方法は、CaMKII、MYPT1-K(またはZIPK)などの同定に適用されました。 このアッセイプロトコルでは、プロテインキナーゼは、基質ポリペプチドを埋め込まれたSDS-ポリアクリルアミドゲル上にロードされ、その後、リン酸化基質を検出するためにオートラジオグラフィーに続いて、放射性ATPを用いた再飽和、リン酸化に供されます。 さらに,放射性ATPを用いてニトロセルロースまたはポリフッ化ビニリデン(PVDF)膜上でキナーゼの自己りん酸化を検出した。 放射性物質は安全規則のためにユーザーのための限定、であるかもしれません。 さらに,りん酸化蛋白質のオートラジオグラムはりん酸化部位の情報を欠いている。
ここでは、従来のゲル内リン酸化アッセイに非放射性代替アッセイを最適化しました。 キナーゼ活性タグ付きウェスタンブロッティング(KAT-WB)という名前は、これが正常に自分自身を自己リン酸Tyrキナーゼだけでなく、ホスホ(P)特異的抗体を使
図1は、Tyr-キナーゼ自己リン酸化アッセイのKAT-WBデータを示しています。 重複ブロットを作るために、抽出物の二つのアリコートは、sdsポリアクリルアミドゲル上にロードされ、電気泳動に供し、その後、タンパク質は、PVDF膜(0.2μ m)のシート 膜を、緩衝化された2-プロパノール、6.0M塩酸グアニジン(Gu-HCl)、3.0M Gu-HCl、0.1M Gu-HClおよび再飽和緩衝液(補足プロトコルを参照)で順次処理した。 4℃での一晩の再飽和工程の後、膜を縦に切断して、2つの重複片を生成した(図1)。 一枚の膜を1m M Mgatpで6 0分間インキュベートした。 他の膜片を対照としてMgatpなしでインキュベートした。 両方のシートを、抗P−Tyr抗体(1:5 0 0 0希釈でクローンPY2 0)で同時に免疫検出に供した。 図1に示すように、複数のP-Tyrバンドは、対照膜(左上)の100、70、45および35kDaで検出された。 これらのP-Tyr蛋白質は抽出前に既にリン酸化されていたと考えられた。 分離後のMgATPとのインキュベーションは、心筋ライセート(図1、右上、レーン2)で45kDaでタンパク質のTyrリン酸化を上昇させ、再生後の膜上のこのキナーゼにおけるTyr残基の自己リン酸化を示している。 図1は、レーン2(-/+MgATP)のデンシトグラムを示しています。 二つのブロット上のタンパク質の同等の負荷を確認するために、フィルタはクーマシー染色に供された(図1、下)。 技術的なノートは、方法を開発する過程で、我々は緩衝2-プロパノールと6M Gu-HClによる治療は、キナーゼ活性の検出のために両方必要であったことがわかった、 したがって、KAT-WBは45-kDa Tyrキナーゼを検出した。

マウス骨格筋(31μ g)、心筋(28μ g)およびNeuro2A細胞(27μ g)の総タンパク質をKAT-western blottingに供した。 再飽和後、膜を縦に2つに切断し、各部分を1m M ATPの非存在下(左)または存在下(右)で3 7℃で6 0分間インキュベートした。 抗P-Tyr抗体を用いた通常の電気化学発光法によりtyr-りん酸化を検出した(top)。 免疫ブロッティング後,各ブロット上の全蛋白質をCoomassi染色(下)により可視化した。 右の数字はマーカータンパク質の分子量(kDa単位)を示しています。 右のボックスは、左右のパネルのレーン2の濃度図を示しています。 ブロットの明るさとコントラストのレベルは同じです。
KAT-WBの別のバージョンは、キナーゼに近接してPVDF膜に吸収された基質タンパク質の部位特異的リン酸化を使用する。 我々は、ホスファターゼホロ酵素阻害剤-1(PHI-1)thr57でのリン酸化は、タイプ1Ser/Thrホスファターゼの阻害剤にこの細胞タンパク質を変換する関心のあるタン 図2Aは、陽性対照組換えZIPKとして、Thr57で組換えPHI-1をリン酸化することが知られているSer/Thrキナーゼを用いたKAT-WBデータを示す。 変性および段階的な再飽和プロセスの後、膜を、組換えPHI-1野生型(WT)または非リン酸化可能バージョン(T57H)を補充した再飽和緩衝液に4℃で一晩浸漬し、0.2mg/mlでリン酸化反応を実行した。 膜上のリン酸化PHI-1は、抗P-PHI-1(Thr57)抗体を用いて検出され、これは組換えZIPKのバンドを明らかにした。 しかし、わずかな信号のみがPHI-1なしまたはPHI-1のT57Hバージョンでコントロール膜上で検出されました。 これらのデータは,膜上のレナチュレートキナーゼが膜上に吸収される基質をリン酸化することができることを示唆している。 組織および細胞中の複数のPHI-1キナーゼを検出するためにKAT-WBを適用した(図2B)。 ラット骨格、心筋およびNeuro2A細胞からの抽出物は、KAT-WBアッセイに供した。 NO-ATPコントロール(左、上)と比較して、P-PHI-1のシグナルは、1mM MgATP(右、上)とインキュベートブロットに登場しました。 P-PHI-1の著名なバンドは、100、60および49kDa(レーン3、オープン矢頭)で神経2A細胞溶解物で検出されました。 しかし、p-PHI-1のバンドは、骨格および心筋(レーン1および2)の抽出物とレーンで明らかではなかった。 P−PHI−1シグナルは、PHI−1なしではリン酸化ステップによって増強されなかった(図2、下、ブランク:BLK)。 これらの結果は、神経細胞ではなく、骨格や心筋で発現する複数のPHI-1キナーゼがあることを示しています。 これにより、細胞や組織内の複数の基質特異的キナーゼを検出するための強力なツールが提供されます。 技術的な注意点は、PHI−1による一晩の再飽和がリン酸化シグナルの検出に必要であり、より高い濃度のPHI−1は染色強度を増加させなかった(図示せず)こ
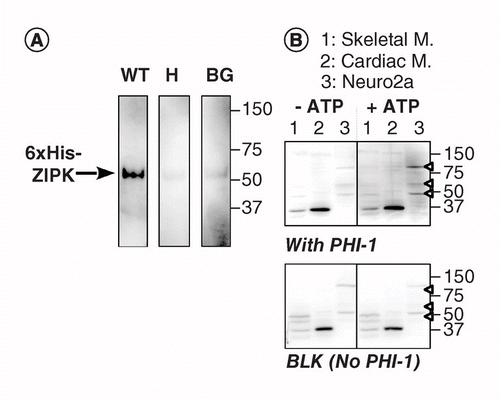
BG:背景;WT:野生型。
これらのデータに基づいて、我々はKAT-WBは、組織や細胞に存在する複数のプロテインキナーゼによってtyrキナーゼの自己リン酸化と目的の選択的基質蛋白質の部位特異的リン酸化を検出することができることを提案している。 KAT-WBは本質的に分子サイズを露出する粗野な混合物のキナーゼ活動を、細胞のエキスのような検出する従来のゲルのリン酸化の試金の利点を共有する。 これら二つのアッセイのもう一つの利点は、これらのアッセイのためのサンプルは、抽出物中のリン酸化および脱リン酸化を排除し、SDSを含む緩衝液で迅速に変性されるため、細胞内のキナーゼの翻訳後修飾(PTMs)は、特定の条件下で所望の時点で保存することができることである。 ほとんどのプロテインキナーゼはPTMを介して調節されている。 KAT-WBは、規制PTMsがまだ特徴付けられていない場合でも、キナーゼ活性の変動を監視することができます。 KAT-WBは、使用される条件下で効果的に再生する単量体酵素のみが活性を示すため、細胞抽出物中のすべてのキナーゼを検出することができない。 しかし、KAT-WBの修飾は、ゲル内リン酸化アッセイによって行われているように、カルモジュリンとサイクリンによって調節されるキナーゼを検出することができるはずである。 再生効率の改善とキナーゼに対する抗体との免疫沈降/免疫デプレッションとの組み合わせは、このアプローチの有用性を拡大する可能性がある。
PTM特異的抗体が利用可能な場合、リン酸化に加えて、kat-WBプロトコルの原理をアセチラーゼ、メチラーゼ、ユビキチンリガーゼなどの他のPTM酵素の検出に適用 部位特異的PTMsを認識する抗体の開発に伴い、活性タグ付きウェスタンブロッティングによってカバーされる研究標的を拡大する。
著者の貢献
江藤M、勝木S、田中Y、竹谷Kが実験を考案し、設計しました。 S Katsuki、Y TanakaおよびK Takeyaは試金を行いました。 データ解析を行ったのは、M Eto、S Katsuki、Y Tanaka、K Takeyaでした。 江藤M、勝木S、田中Y、竹谷Kが論文を書いた。
謝辞
著者らは、原稿の校正と貴重な提案に対してDL Brautiganに感謝したいと思います。
金融&競合利益開示
本研究は、日本学術振興会科研費(JP19K06573およびJP19H03125)およびうま味研究会、今治市および愛媛県からの資金、H Awagiからの贈 著者は、開示されたものとは別に、原稿で議論された主題または資料に対する財政的関心または財政的対立を有する組織または団体と、他の関連する所属または財政的関与を有していない。
この原稿の制作には執筆支援は利用されていませんでした。
Open access
この作品はAttribution-NonCommercial-NoDerivatives4.0Unported Licenseの下でライセンスされています。 このライセンスのコピーを表示するには、次のページを参照してくださhttp://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. Hornbeck PV,Zhang B,Murray B et al. PhosphoSitePlus、2014:突然変異、PTMsおよび再校正。 Nucleic Acids Res.4 3,D5 1 2−D5 2 0(2 0 1 5)。Crossref,Medline,CAS,Google Scholar
- 2. Celenza JL,Carlson M.蛋白質のしみの蛋白質のキナーゼ活動のRenaturation。 方法Enzymol。 Academic Press,Cambridge Massachusetts,34,423-430(1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. ドデシル硫酸ナトリウム-ポリアクリルアミドゲルから膜への電気泳動移動後のカルシウム/カルモジュリン依存性プロテインキナーゼ活性の再飽和。 アナル… バイオケム 211(1), 131–138 (1993).Crossref,Medline,CAS,Google Scholar
- 6. Macdonald JA,Borman MA,Muranyi A et al. 内因性平滑筋ミオシンホスファターゼ関連キナーゼの同定。 プロク… ナトル-アカデミー所属。 サイ… アメリカ98(5), 2419-2424 (2001).Crossref,Medline,CAS,Google Scholar
- 7. ウーテン-ムワッ… キナーゼ基質を同定する方法としてのゲル内キナーゼアッセイ。 サイ… STKE2002(153),pl15(2002).Medline,Google Scholar
- 8. Celenza J,Carlson M.グルコース抑制からの放出に必須である酵母遺伝子は、プロテインキナーゼをコードする。 科学233(4769), 1175-1180 (1986).Crossref,Medline,CAS,Google Scholar
- 9. Eto M、Karginov A、Brautigan DL。 蛋白質のタイプ1ホスファターゼホロ酵素の新しいリン蛋白質の抑制剤。 生化学38(51), 16952-16957 (1999).Crossref,Medline,CAS,Google Scholar
- 10. Macdonald JA,Eto M,Borman MA et al. MYPT関連キナーゼによるミオシンホスファターゼの阻害剤であるCPI-17のデュアルSerおよびThrリン酸化。 FEBS Lett. 493(2–3), 91–94 (2001).Crossref,Medline,CAS,Google Scholar
- 11. Eto M,Leach C,Tountas NA et al. タンパク質ホスファターゼ-1のリンタンパク質阻害剤。 方法Enzymol。 366, 243–260 (2003).Medline,CAS,Google Scholar
- 12. Rousell J,Haddad El B,Lindsay MA et al. 血小板由来成長因子によるm2ムスカリン受容体遺伝子発現の調節:ダウンレギュレーションプロセスにおける細胞外シグナル調節プロテインキナーゼ モル ファーマコール… 52(6), 966–973 (1997).Crossref,Medline,CAS,Google Scholar