passief Transport
om te begrijpen hoe stoffen passief door een celmembraan bewegen, is het noodzakelijk concentratiegradiënten en diffusie te begrijpen. Een concentratiegradiënt is het verschil in concentratie van een stof in een ruimte. Moleculen (of ionen) zullen zich verspreiden/verspreiden van waar ze meer geconcentreerd zijn naar waar ze minder geconcentreerd zijn totdat ze gelijkmatig verdeeld zijn in die ruimte. (Wanneer moleculen op deze manier bewegen, wordt gezegd dat ze naar beneden hun concentratiegradiënt.) Drie veel voorkomende vormen van passief vervoer omvatten eenvoudige diffusie, osmose, en gefaciliteerde diffusie.
eenvoudige diffusie is de beweging van deeltjes van een gebied met een hogere concentratie naar een gebied met een lagere concentratie. Een aantal gemeenschappelijke voorbeelden zullen dit concept helpen illustreren. Stel je voor dat je in een gesloten badkamer bent. Als een fles parfum werd gespoten, zouden de geurmoleculen van nature diffunderen van de plek waar ze de fles verlieten naar alle hoeken van de badkamer, en deze diffusie zou doorgaan tot er geen concentratiegradiënt meer overblijft. Een ander voorbeeld is een lepel suiker in een kopje thee. Uiteindelijk zal de suiker door de thee diffunderen totdat er geen concentratiegradiënt overblijft. In beide gevallen, als de kamer warmer is of de thee heter, vindt diffusie nog sneller plaats omdat de moleculen tegen elkaar botsen en zich sneller verspreiden dan bij koelere temperaturen. Het hebben van een interne lichaamstemperatuur rond 98.6 ° F helpt zo ook in verspreiding van deeltjes binnen het lichaam.
bezoek deze link om te zien hoe diffusie wordt voortgestuwd door de kinetische energie van moleculen in oplossing. Hoe beïnvloedt de temperatuur de diffusiesnelheid en waarom?
wanneer een substantie in grotere concentratie aan één kant van een semipermeable membraan, zoals het plasmamembraan bestaat, zal om het even welke substantie die zijn concentratiegradiënt over het membraan kan bewegen dit doen. Denk aan stoffen die gemakkelijk kunnen diffunderen door de lipide bilayer van het celmembraan, zoals de gassen zuurstof (O2) en CO2. O2 verspreidt over het algemeen in cellen omdat het buiten hen meer geconcentreerd is, en CO2 verspreidt typisch uit cellen omdat het binnen hen meer geconcentreerd is. Geen van deze voorbeelden vereist om het even welke energie van de kant van de cel, en daarom gebruiken zij passief vervoer om zich over het membraan te bewegen. Voordat u verder gaat, moet u de gassen bekijken die over een celmembraan kunnen diffunderen. Omdat cellen snel zuurstof verbruiken tijdens het metabolisme, is er typisch een lagere concentratie van O2 binnen de cel dan buiten. Als gevolg hiervan zal zuurstof diffuus uit de interstitiële vloeistof direct door de lipide bilayer van het membraan en in het cytoplasma binnen de cel. Aan de andere kant, omdat cellen CO2 produceren als een bijproduct van het metabolisme, CO2 concentraties stijgen binnen het cytoplasma; daarom, CO2 zal bewegen van de cel via de lipide bilayer en in het interstitiële vocht, waar de concentratie lager is. Dit mechanisme van moleculen die zich verspreiden van waar ze meer geconcentreerd zijn naar waar ze minder concentratie zijn, is een vorm van passief transport dat eenvoudige diffusie wordt genoemd (figuur 3.15).
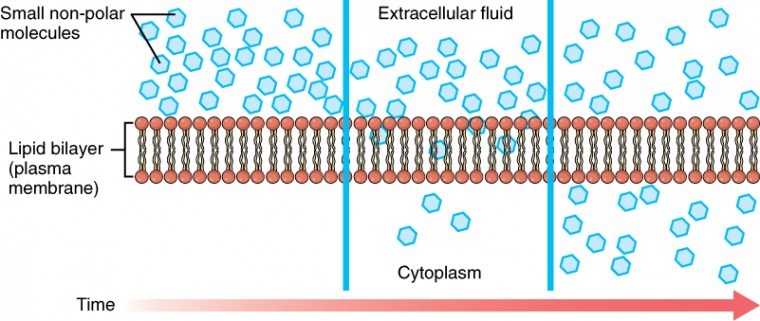
figuur 3.15. Eenvoudige verspreiding over het celmembraan (Plasma) de structuur van de lipide bilayer staat slechts kleine, apolaire substanties zoals zuurstof en kooldioxide toe om door het celmembraan, onderaan hun concentratiegradiënt, door eenvoudige verspreiding over te gaan.
osmose is de diffusie van water door een semipermeabel membraan (figuur 3.16). Het Water kan zich vrij over het celmembraan van alle cellen bewegen, of door eiwitkanalen of door tussen de lipidestaarten van het membraan zelf te glijden. Echter, het is concentratie van opgeloste stoffen in het water die bepalen of water zal bewegen in de cel, uit de cel, of beide.

figuur 3.16. Osmose osmose is de diffusie van water door een semipermeable membraan langs zijn concentratiegradiënt. Als een membraan doorlaatbaar is voor water, maar niet voor een opgeloste stof, zal water zijn eigen concentratie egaliseren door te diffunderen naar de kant van de lagere waterconcentratie (en dus de kant van de hogere opgeloste concentratie). In het bekerglas aan de linkerkant is de oplossing aan de rechterkant van het membraan hypertoon.
opgeloste stoffen in een oplossing creëren osmotische druk, een druk die water trekt. Osmose komt voor wanneer er een onbalans van opgeloste stoffen buiten een cel versus binnen de cel is. Hoe meer opgeloste stof een oplossing bevat, hoe groter de osmotische druk die oplossing zal hebben. Een oplossing die een hogere concentratie van opgeloste stoffen heeft dan een andere oplossing wordt gezegd te zijn hypertoon. Watermoleculen hebben de neiging om te diffunderen tot een hypertone oplossing omdat de hogere osmotische druk water trekt (figuur 3.17). Als een cel in een hypertone oplossing wordt geplaatst, zullen de cellen verschrompelen of krenen aangezien het water de cel via osmose verlaat. Een oplossing met een lagere concentratie opgeloste stoffen dan een andere oplossing zou hypotoon zijn. Cellen in een hypotone oplossing nemen te veel water op en zwellen op, met het risico op barsten, een proces genaamd lysis. Een kritisch aspect van homeostase in levende dingen is het creëren van een interne omgeving waarin alle cellen van het lichaam in een isotone oplossing, een omgeving waarin twee oplossingen hebben dezelfde concentratie van opgeloste stoffen (gelijke osmotische druk). Wanneer cellen en hun extracellulaire omgevingen isotoon zijn, is de concentratie van watermoleculen buiten en binnen de cellen hetzelfde, zodat water zowel in als uit stroomt en de cellen hun normale vorm (en functie) behouden. Verschillende orgaansystemen, met name de nieren, werken om deze homeostase in stand te houden.

figuur 3.17. Concentratie van oplossingen een hypertone oplossing heeft een opgeloste concentratie hoger dan een andere oplossing. Een isotone oplossing heeft een opgeloste concentratie gelijk aan een andere oplossing. Een hypotone oplossing heeft een opgeloste concentratie lager dan een andere oplossing.