szczegóły techniczne: Chemia
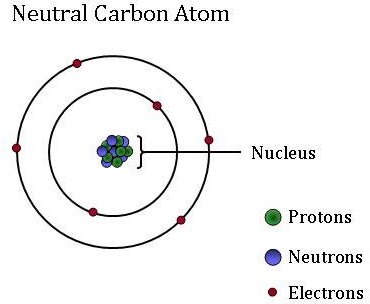
Atomy, które są podstawową, podstawową jednostką całej materii, mogą się znacznie różnić od siebie. Chociaż atomy są zbyt małe, aby je zobaczyć bez użycia mikroskopów o dużej mocy, składają się z jeszcze mniejszych cząstek: protonów, neutronów i elektronów.
elektrony, które są niezwykle lekkimi, ujemnie naładowanymi cząstkami, krążą wokół centralnej masy-jądra atomu. Atomy mogą zyskać lub stracić elektrony, które zmieniają ładunek atomu (tworząc jony). Jednak atom pozostaje tym samym elementem, niezależnie od tego, czy ma ładunek dodatni, ujemny, czy neutralny.
małe, gęste jądro (lub centrum) atomu zawiera inne składniki–protony i neutrony. Protony są dodatnio naładowanymi cząstkami, a liczba protonów jest zawsze stała dla danego pierwiastka. Innymi słowy, liczba protonów jest tym, co nadaje każdemu elementowi jego unikalną, indywidualną tożsamość. Na przykład atom węgla ma sześć protonów, ale atom z pięcioma protonami to Bor, podczas gdy atom z siedmioma protonami to pierwiastek azot.
neutrony są neutralne – nie mają ładunku. Izotopy to Atomy tego samego pierwiastka, które mają różną liczbę neutronów. Chociaż izotopy tego samego pierwiastka są bliźniacze, jeśli chodzi o reaktywność, to różna liczba neutronów oznacza, że mają one inną masę. Niektóre izotopy są bardziej obfite w niektórych materiałach niż inne, ponieważ niektóre procesy fizyczne i chemiczne „preferują” jeden izotop nad drugim. Te różnice w obfitości izotopowej są używane jako” etykiety ” do identyfikacji różnych źródeł CO2 znalezionych w próbce CO2 atmosferycznej. Naukowcy atmosferyczni NOAA używają tych etykiet izotopowych do określenia, jaki procent tego węgla pochodzi z paliw kopalnych, ziemskiej biosfery lub z oceanu.
izotopy węgla
izotopy węgla występują w trzech postaciach. Zdecydowanie najczęstszym izotopem węgla jest węgiel-12 (12C), który oprócz sześciu protonów zawiera sześć neutronów. Następny najcięższy izotop węgla, węgiel-13 (13C), ma siedem neutronów. Zarówno 12C, jak i 13C nazywane są stabilnymi izotopami, ponieważ z czasem nie rozpadają się na inne formy lub pierwiastki. Rzadki izotop węgla-14 (14C) zawiera w swoim jądrze osiem neutronów. W przeciwieństwie do 12C i 13C, izotop ten jest niestabilny lub radioaktywny. Z czasem atom 14C rozpadnie się w stabilny produkt.

zdecydowana większość całego węgla znalezionego na Ziemi ma 12C. prawie 99% całego węgla na Ziemi ma taką formę. Podczas gdy tylko około 1% całego węgla na Ziemi ma postać izotopową 13C, 14C jest nadal znacznie rzadszy. Tylko jeden z bilionów atomów węgla to 14C.
aby dowiedzieć się, jak niewiele jest atomów 14C w porównaniu do 12C, porównajmy jeden do jednego biliona. Bilion to milion milionów. Jeśli ustawisz biliony dolarów, rozciągnie się prawie od ziemi do słońca!