celem terapii ablacyjnej jest zniszczenie nabłonka Barretta do wystarczającej głębokości, aby wyeliminować metaplazję jelit i umożliwić odrost płaskonabłonkowego nabłonka. Próbowano wielu sposobów, zwykle w połączeniu z terapią medyczną lub chirurgiczną, ponieważ skuteczna ablacja wydaje się wymagać środowiska zobojętniającego kwas.
badania na ludziach przeprowadzono z zastosowaniem ablacji o częstotliwości radiowej (RFA), terapii fotodynamicznej (PDT), koagulacji plazmą argonową (APC), wielobiegunowej elektrokoagulacji (MPEC), sond grzewczych, różnych form laserów, endoskopowej resekcji błony śluzowej (EMR) i krioterapii.
terapia ablacyjna pojawia się jako realna alternatywa dla resekcji chirurgicznej lub przełyku u pacjentów z dysplazją wysokiego stopnia w przełyku Barretta. W rzeczywistości, w większości głównych ośrodków medycznych ablacji jest terapia pierwszego rzutu. Badanie przeprowadzone przez Prasad wykazało, że 5-letni wskaźnik przeżycia u pacjentów z dysplazją wysokiego stopnia w przełyku Barretta, którzy byli leczeni PDT i EMR, był porównywalny do wskaźnika przeżycia u pacjentów leczonych przełykiem.
retrospektywne badanie kohortowe z udziałem 166 pacjentów z dysplastycznym przełykiem Barretta wykazało, że leczenie endoluminalne łączące endoskopową resekcję błony śluzowej i ablację jest bezpiecznym i skutecznym leczeniem przełyku Barretta.
ablacja o częstotliwości radiowej
RFA jest zatwierdzona przez FDA do zwalczania dysplazji wysokiego stopnia w przełyku Barretta. Jest to również opcja leczenia dysplazji niskiego stopnia u Barrett esophgus, pod warunkiem, że ryzyko i korzyści są dokładnie omówione z pacjentem. RFA to oparty na balonie, bipolarny system ablacji o częstotliwości radiowej. Technika ta wymaga użycia balonów wielkości w celu określenia wewnętrznej średnicy docelowej części przełyku. Następnie umieszcza się elektrodę na bazie balonu o długości 3 cm, która zawiera ciasno rozmieszczone, dwubiegunowe elektrody, które zmieniają biegunowość. Elektroda jest następnie podłączana do generatora częstotliwości radiowej i wstępnie wybrana ilość energii jest dostarczana w czasie krótszym niż 1 sekunda przy 350 W.
Shaheen i wsp. wykazali, że RFA wiąże się z wysokim wskaźnikiem całkowitego wyeliminowania dysplazji i metaplazji jelitowej oraz zmniejszonym ryzykiem progresji choroby u pacjentów z dysplastycznym przełykiem Barretta.
w badaniu całkowita eradykacja wystąpiła u 90,5% pacjentów z dysplazją niskiego stopnia, którzy otrzymali ablację o częstotliwości radiowej, w porównaniu z 22.7% pacjentów w grupie kontrolnej, którzy przeszli pozorowany zabieg. Wśród pacjentów z dysplazją wysokiego stopnia całkowita eradykacja wystąpiła u 81% pacjentów w grupie ablacyjnej, podczas gdy całkowita eradykacja wystąpiła tylko u 19% pacjentów w grupie kontrolnej.
u pacjentów z grupy ablacji postęp choroby był mniejszy niż u pacjentów z grupy kontrolnej (odpowiednio 3,6% vs 16,3%) i mniej nowotworów niż u pacjentów z grupy kontrolnej (odpowiednio 1,2% vs 9,3%).
w randomizowanym badaniu z udziałem 136 pacjentów z przełykiem Barretta i dysplazją niskiego stopnia, Phoa i wsp. stwierdzili, że w porównaniu z nadzorem endoskopowym, endoskopowa ablacja radiofrekwencyjna (RFA) znacząco zmniejszyła wskaźnik progresji nowotworu do dysplazji wysokiego stopnia lub gruczolakoraka.
w ciągu 3 lat obserwacji RFA zmniejszyło ryzyko wystąpienia dysplazji lub gruczolakoraka wysokiego stopnia z 26, 5% do 1, 5% (P < .001) I zmniejszyło ryzyko progresji do gruczolakoraka z 8,8% do 1,5% (P = .03). Wśród pacjentów z grupy ablacji wskaźnik całkowitej eradykacji wynosił 92,6% w przypadku dysplazji i 88,2% w przypadku metaplazji jelitowej, w porównaniu z 27,9% w przypadku dysplazji i 0% W przypadku metaplazji jelitowej wśród pacjentów z grupy kontrolnej.
zastosowanie endoskopowej resekcji błony śluzowej przed RFA wydaje się znacznie zmniejszać ryzyko niepowodzenia leczenia w przypadku dysplazji związanej z przełykiem Barretta i gruczolakoraka wewnątrzczaszkowego związanego z przełykiem Barretta, podczas gdy istotnym czynnikiem predykcyjnym niepowodzenia leczenia wydaje się obecność gruczolakoraka wewnątrzczaszkowego obejmującego 50% lub więcej obszaru metapastycznego kolumny w badaniu indeksowym.
PDT
PDT polega na użyciu środka fotouczulającego, który gromadzi się w tkance i indukuje lokalną martwicę poprzez produkcję wewnątrzkomórkowych wolnych rodników po ekspozycji na światło o określonej długości fali. Zazwyczaj hematoporfiryna jest stosowana jako środek fotouczulający, ponieważ ma większe powinowactwo do tkanki nowotworowej.
zastosowano również inny środek, kwas 5-aminolewulinowy (ALA), który indukuje endogenną protoporfirynę IX i wykazuje selektywność dla błony śluzowej w głębszych warstwach podśluzówkowych. Wyniki były obiecujące dla regresji przełyku Barretta, a także dla leczenia dysplazji i raka powierzchownego.
stosując PTD w leczeniu 100 pacjentów-w tym 73 z dysplazją wysokiego stopnia i 13 z powierzchownym gruczolakorakiem-Overholt i wsp. stwierdzili, że błona śluzowa Barretta została całkowicie wyeliminowana u 43 pacjentów, a dysplazja wyeliminowana u 78 pacjentów.
inne badania wykazały podobne wskaźniki odpowiedzi, ale zaobserwowano nabłonek Barretta pod powierzchowną warstwą płaskonabłonkową, co wskazuje, że głębiej umieszczone komórki pluripotencjalne mogą być zachowane. Ponadto PDT jest kosztownym i czasochłonnym przedsięwzięciem, a wczesne stosowanie było skomplikowane przez zwężenie przełyku wymagające rozszerzenia u 58% pacjentów. PDT został w dużej mierze zastąpiony przez RFA w większości ośrodków medycznych wykonujących ablację.
ablacja APC
APC jest metodą bezkontaktowej koagulacji prądowej wysokiej częstotliwości, w której spalanie tkanki zatrzymuje się natychmiast po ablacji obszaru. Jedno badanie z zastosowaniem wysokiej mocy APC wykazało całkowite przywrócenie płaskonabłonkowej błony śluzowej u 33 z 33 pacjentów po średnio 1,96 sesji. Głównymi powikłaniami były bóle w klatce piersiowej i odynofagia, które wystąpiły u 57,5% pacjentów i trwały 3-10 dni. Tylko u 3 pacjentów wystąpiły zwężenia, które łatwo leczono rozszerzeniem. Tylko 1 nawrót endoskopowy, jak również histologiczny, obserwowano po 10,6 miesiącu obserwacji, ale było to u pacjenta z nieskuteczną fundoplikacją Nissena.
inne badania były mniej zachęcające, z utrzymującymi się resztkowymi ogniskami nabłonka Barretta pod okładziną neosquamous w 22-29%; odnotowano głębokie owrzodzenie przełyku z masywnym krwawieniem, perforacją, a nawet zgonem.
ablacja MPEC
MPEC to metoda, w której błona śluzowa jest ablowana przez bezpośredni kontakt z sondą elektrokoagulacyjną. Sampliner i wsp. zastosowali tę technikę do leczenia 10 pacjentów z LSBE, używając połowy przełyku pacjenta jako kontroli wewnętrznej i stwierdzili, że u wszystkich 10 pacjentów leczonych segment został wyeliminowany przez kryteria wizualne i biopsji po 6 miesiącach; nieleczony segment pozostał niezmieniony u pacjentów, pomimo supresji kwasu. Leczenie trwało średnio 2,5 sesji, a u 5 pacjentów wystąpiły powikłania w 75 wszystkich sesjach (2 przemijające odynofagie, 1 przemijająca dysfagia, 1 ból w klatce piersiowej i 1 krwawienie z górnego odcinka przewodu pokarmowego).
w trwającym 10 lat badaniu kontrolnym z udziałem 139 pacjentów z przełykiem Barretta leczenie ablacyjne MPEC wiązało się z powikłaniami (wszystkie niewielkie) u mniej niż 5% pacjentów. Nawracający przełyk Barretta wystąpił u mniej niż 5% pacjentów. U żadnego z pacjentów nie rozwinął się gruczolakorak ani dysplazja przełyku o wysokim stopniu zaawansowania. Wyniki te wskazywały na długoterminową skuteczność i bezpieczeństwo ablacji błony śluzowej przełyku Barretta.
ablacja laserowa
lasery zostały wykorzystane w wielu małych badaniach do eradykacji przełyku Barretta. Wyniki były mniej zgodne z tą modalnością niż z tymi wymienionymi powyżej. Badania, które wykazały pełną lub częściową regresję endoskopowo były mylone przez utrzymywanie się elementów gruczołowych pod nabłonkiem neosquamous w aż jednej trzeciej przypadków.
krioablacja
jedną z nowszych technik ablacyjnych jest niskociśnieniowa ablacja kriospray przy użyciu ciekłego azotu, pionierska w instytucji autora. Elementy niskociśnieniowego urządzenia do krioablacji natryskowej są następujące:
-
zbiornik ciekłego azotu
-
konsola elektroniczna-do monitorowania i sterowania uwalnianiem kriogenu
-
Podwójny pedał nożny – do sterowania uwalnianiem kriogenu i ogrzewaniem cewnika
-
cewnik-wielowarstwowy, 7-9F, z otwartą końcówką cewnik do rozpylania nadolbrzymowego gazu azotowego przez górny Endoskop
mechanizm urazu jest unikalny w stosunku do innych technik ablacyjnych. Krioablacja indukuje apoptozę, powoduje krionekrozę w super niskich temperaturach (-76°C do -196°C), powoduje przemijające niedokrwienie i może powodować stymulację immunologiczną. Nabłonek Barretta jest odporny na apoptozę i dlatego może być wyjątkowo odpowiedni do leczenia metodą krioablacji.
w pilotażowym badaniu w instytucji autorskiej z zastosowaniem krioablacji w przełyku Barretta ze stopniami dysplazji od braku dysplazji do wieloogniskowej dysplazji wysokiego stopnia uzyskano całkowite endoskopowe odwrócenie przełyku Barretta w 78% przypadków, bez podkwasowej SIM lub dysplazji po 6 miesiącach obserwacji. Wyniki te będą wymagały potwierdzenia w innych instytucjach. (Zobacz zdjęcia poniżej.)
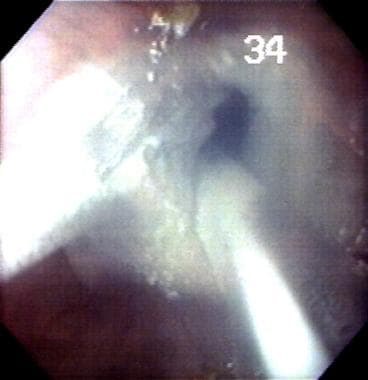 krioablacja błony śluzowej przełyku w przełyku Barretta (BE). Jest to jedna z najnowszych eksperymentalnych terapii ablacyjnych przełyku wykonanych w autorskim laboratorium.
krioablacja błony śluzowej przełyku w przełyku Barretta (BE). Jest to jedna z najnowszych eksperymentalnych terapii ablacyjnych przełyku wykonanych w autorskim laboratorium. 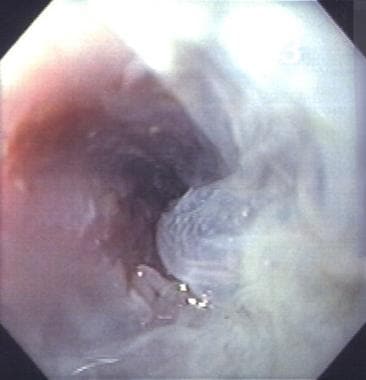 pęcherze warstwy śluzówki przełyku po krioablacji w przełyku Barretta (BE).
pęcherze warstwy śluzówki przełyku po krioablacji w przełyku Barretta (BE).