- Como pode uma molécula pequena, como o etanol ser a raiz de tanta miséria humana?Aqui propomos chegar ao fundo das consequências químicas de uma noite de celebração ao excesso.
- 2.1 metabolismo do etanol
- etanol acetaldeído
- acetaldeído ácido acético
- 2.2 alterações metabólicas adicionais
- Prof. Klaus Roth
Como pode uma molécula pequena, como o etanol ser a raiz de tanta miséria humana?Aqui propomos chegar ao fundo das consequências químicas de uma noite de celebração ao excesso.
2.1 metabolismo do etanol
etanol (CH3CH2OH) é oxidado no fígado para acetaldeído (CH3CHO, etanal), que em um segundo passo é oxidado em ácido acético (CH3COOH, ácido etanóico) (Fig. 2). O ácido acético é finalmente decomposto em dióxido de carbono e água no ciclo do ácido cítrico .
no processo, o etanol fornece uma quantidade considerável de energia: 450 kcal/100g, um valor entre os de glucose (400 kcal/100g) e gordura (930 kcal/100g). As bebidas alcoólicas devem, portanto, ser classificadas entre os géneros alimentícios.
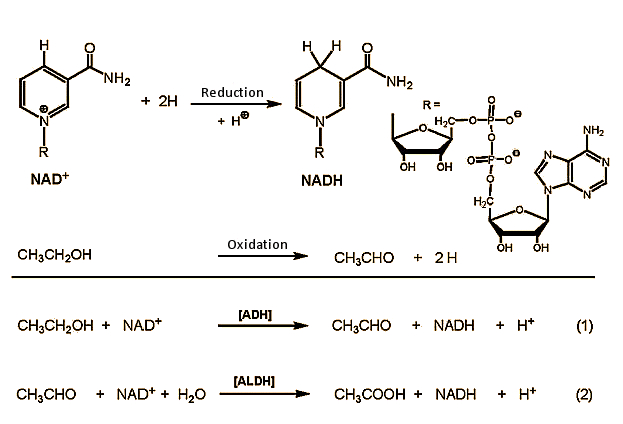
Figura 2. Metabolismo do etanol no organismo.
etanol acetaldeído
na primeira etapa, o etanol é oxidado em células do fígado para acetaldeído, com NAD+ (nicotinamida adenina dinucleótido) como agente oxidante. Esta reacção é catalisada por enzimas desidrogenase do álcool (ADH), das quais o corpo humano tem muitos disponíveis. Eles são todos estruturalmente muito semelhantes, e sempre consistem de duas subunidades, cada uma contendo 374 aminoácidos. As subunidades α-, β – e γ-adequadas à oxidação do etanol são codificadas em três genes do nosso cromossoma 4, e podem ser combinadas à vontade com qualquer um dos seis dímeros ADH (αα, ββ, γγ, αβ, αγ, βγ). As actividades catalíticas das várias combinações diferem apenas ligeiramente.
além disso, existem também diversas variedades das subunidades β e γ. ADH contendo subunidades β1-comuns entre os europeus-oxida ca. 110 mg de etanol por hora e kg de peso corporal, enquanto que a versão β2, mais comum entre Asiáticos, é significativamente mais cataliticamente ativa, a 130 mg/kg/h.
o abuso crónico do álcool induz uma regulação de alto nível nas células hepáticas de um mecanismo normalmente subordinado de oxidação do etanol: o sistema microssomal de oxidação do etanol (MEOS). Neste caso, uma monooxigenase especial do citocromo P450 é sintetizada em maior extensão, que por sua vez metaboliza o etanol independentemente da ADH. Na sequência de reação de MEOS, o etanol é oxidado diretamente pelo oxigênio molecular, ou seja, não há Acoplamento energético à cadeia respiratória na mitocôndria. A energia liberada através da oxidação de meos do etanol é simplesmente descartada na forma de calor, e — em contraste com o metabolismo ADH “normal” – não é armazenado quimicamente.
este facto foi demonstrado de forma impressionante no ser humano: num estudo controlado, a ingestão diária normal de calorias foi duplicada com uma quantidade suplementar de etanol ou chocolate. O resultado: usando etanol, o peso corporal após duas semanas permaneceu inalterado, mas os comedores de chocolate ganharam 3 kg .
acetaldeído ácido acético
dois aldeídos desidrogenases (ALDHs) estão prontos para posterior oxidação do etanol. A oxidação rápida também é importante, uma vez que o acetaldeído é tóxico. Os ALDHs cumprem Sua tarefa de forma exemplar: acetaldeído tóxico é oxidado a ácido acético inofensivo ao longo de duas vias: uma pequena fração é oxidada em células hepáticas no citosol por aldeído desidrogenase ALDH1, enquanto a fração principal é oxidada na mitocôndria por ALDH2.
In the oxidation of both alcoh and also acetaldeide, NAD+ (nicotinamide adenine dinucleotide) is the actual oxidizing agent. A concentração sanguínea de acetaldeído permanece geralmente inferior a 2 µmol / L, em comparação com uma concentração típica de etanol de 5 mmol / L.
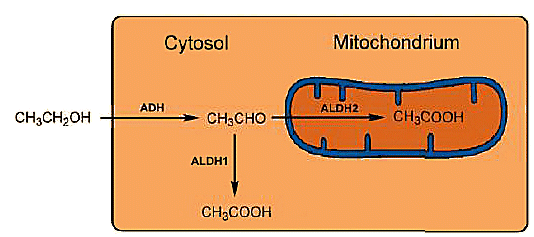
Figura 3. Metabolismo intracelular do etanol.
cada ALDH consiste em quatro subunidades idênticas, cada uma com 500 aminoácidos, que no caso de ALDH1 — encontrado no citosol — é localizado no cromossoma 9, enquanto ALDH2 da mitocôndria é localizado no cromossomo 12. A correspondência sequencial entre os dois ALDHs é de apenas 68 %, e seus efeitos catalíticos diferem de acordo: ALDH2 da mitocôndria é muito mais ativo do que ALDH1 do citosol (Fig. 3).
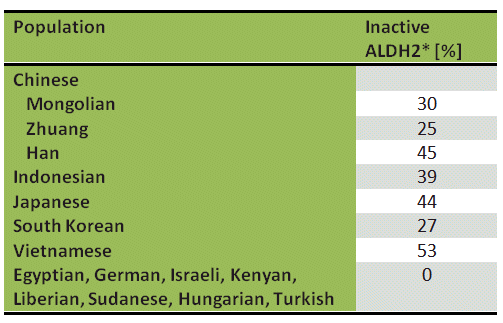
a sensibilidade incomum ao álcool exibida por parte da população mundial, particularmente os da Ásia, é devido a uma ALDH2 alterada. Ao contrário dos europeus e dos africanos, 44 % dos japoneses (Tab. 1) têm uma variante enzimática ALDH2 nas mitocôndrias das suas células hepáticas. Esta modificação tem a designação ALDH2*, onde um ácido glutâmico na posição 487 foi substituído por uma lisina . A mutação é cataliticamente inactiva, e as pessoas com ALDH2* são capazes de metabolizar o acetaldeído apenas lentamente, usando a via ALDH1 menos activa.
a consequência: em poucos minutos do consumo de etanol, a sua concentração de acetaldeído no sangue aumenta dramaticamente. Enquanto para um Europeu (ALDH2) com um teor de álcool no sangue de 0,5‰, o nível de acetaldeído no sangue permanece abaixo de 2 µmol/L, para um japonês com ALDH2*, este valor pode atingir 35 µmol/l.
acetaldeído tem um poderoso efeito vasodilatador, fazendo com que o rosto se torne vermelho, ou “flush” (síndrome de rubor). Ao mesmo tempo, ocorrem sintomas de ressaca violentos (dores de cabeça, tremores, sensação de mal estar) .
Quadro 1. Prevalência de aldeído-desidrogenase inactivo (ALDH2*) em várias populações étnicas .
os sintomas idênticos são observados para os europeus com ALDH2 activo se a enzima ficar bloqueada. Este efeito pode ser induzido à vontade com a preparação farmacêutica Antabuse®, um composto que bloqueia completamente o ALDH2. O choque ascendente resultante na concentração de acetaldeído, com os seus graves sintomas de ressaca, atormenta os toxicodependentes na fase de abstinência que estão a ser submetidos a tratamento, após qualquer indulgência em álcool.
da mesma forma, depois de saborear um prato que acontece para conter o cogumelo Coprinus atramentarius, geralmente conhecido como o “comum de tinta cap” ou “tippler bane”, deve-se, para os próximos três dias, estritamente evitar todas as bebidas alcoólicas (Fig. 4). Caso contrário, após apenas alguns minutos, os principais sintomas de ressaca irão desenvolver-se, tais como rubor, palpitações cardíacas e pulso elevado, dores de cabeça, náuseas, vómitos, ataques de sudação e tremor dos membros. Casos especialmente graves podem até resultar em colapso . Este quadro clínico é conhecido como síndrome de Coprinus. Pode persistir por várias horas, embora até agora não tenham sido registrados casos de morte.
.gif)
Figura 4. Síndrome de Coprinus.
a causa da síndrome de Coprinus é um aumento significativo da concentração de acetaldeído no sangue devido a um componente do cogumelo que bloqueia a oxidação do acetaldeído no ácido acético. Os sintomas observados são idênticos aos observados após a ingestão de álcool durante o tratamento com Antabuse (dissulfiram) . O culpado pode ser coprina, N5-(1-hidroxiciclopropil)-L-glutamina (2), que foi isolado deste fungo . Mais recentemente, foi demonstrado que não é a coprina que bloqueia a aldeído desidrogenase ALDH2, induzindo assim os sintomas, mas sim um dos seus metabolitos, provavelmente 1-aminociclopropanol (3) ou o hidrato de ciclopropanona (4) .
2.2 alterações metabólicas adicionais
etanol e sua degradação — este último processo a uma velocidade vertiginosa-levam a alterações fisiológicas que persistem muito para além do período de intoxicação. Do ponto de vista químico, o etanol é um agente redutor rico em calorias, cujo processamento absorve quantidades consideráveis do agente oxidante NAD+ e reduz a razão NAD+/NADH de 4:1 a 2:1. Esta diminuição do potencial de oxidação da célula provoca uma alteração massiva e de grande alcance no metabolismo, por exemplo, uma diminuição na síntese de glicose, acumulação de ácido láctico, aumento da produção de lípidos e diminuição da degradação de gorduras e proteínas.
síntese diminuída da glucose por sua vez diminui o nível de açúcar no sangue, com a consequente fraqueza física geral. No caso de um diabético acostumado à medicação, isso pode produzir a temida hipoglicemia. Entretanto, a acumulação de ácido láctico pode diminuir o pH do sangue abaixo de 7, 36 (acidose).
a elevada síntese de ácidos gordos, juntamente com a diminuição dos lípidos (gordura) e do metabolismo proteico, leva à deposição de gordura e proteínas no fígado. Este é um processo reversível no caso de abuso ocasional de álcool, mas em uma situação crônica que leva diretamente ao “fígado gordo”, que, juntamente com outros danos induzidos pelo álcool no metabolismo do fígado pode terminar em cirrose do fígado ou carcinoma.
O consumo de etanol está sujeito não só a desvantagens, no entanto. A concentração plasmática do colesterol HDL (“colesterol bom”) aumenta e a capacidade de coagulação do sangue diminui. Ambos oferecem protecção contra ataques cardíacos e AVC , o que pode ajudar a explicar a menor prevalência de doenças circulatórias fatais em certos países mediterrânicos (Dieta Mediterrânica). Em alguns casos, no entanto, o vinho tinto é consumido lá em quantidades tão grandes que, embora doença coronária e acidente vascular cerebral são menos comuns, doenças do fígado — a partir de fígado gordo todo o caminho para o carcinoma — são ainda mais comuns.
como sempre-livremente adaptado de Paracelsus-a moderação provavelmente representa a média dourada.
-
química de uma ressaca-álcool e suas consequências Parte 1
► Read more on the chemistry of a hangover in part 3
K. Roth, Chem. Unserer Zeit 2005, 39, 348. DOI: 10.1002 / ciuz.200590067
detalhes da estrutura e mecanismo catalítico da oxidação do etanol com ADH: www.chemie.tu-darmstadt.de/akplenio/moproc/zink/alkoholdehydrogenase / ADH_start.htm
C. S. Lieber, New Engl. J. Med. 1973, 288, 356. DOI: 10.1056/NEJM197302152880710
Hsu et al., Procedimento. Natl. Acad. Ciência. 1985, 82, 3771. Link
H. W. Goedde, D. P. Argawal, Alcoholism, Pergamon Press, New York 1989.
D. Crabb et al., J. Clin. Investir. 1989, 83, 314. DOI: 10.1172 / JCI113875
T. L. Wall et al., J. Stud. Alcohol 2000, 61, 13. Link
D. Michelot, Natural Toxin 1992, 1, 73. DOI: 10.1002 / nt.2620010203
G. M. Hatfield, J. P. Schaumberg, Lloydia 1975, 38, 489. PMID: 1241098
P. Lindberg et al., Chem. Comunicacao. 1975, 946. DOI: 10.1039 / c39750000946
P. Lindberg et al., J. Chem. Soc. Perkin I 1977, 684. DOI: 10.1039/P197700684
J. S. W. Wiseman, R. H. Abeles, Biochemistry 1979, 18, 427. DOI: 10.1021 / bi00570a006
K. Roth, Chem. Unserer Zeit 2004, 38, 426. DOI: 10.1002 / ciuz.200490092
Prof. Klaus Roth
Freie Universität Berlin, Germany.
O artigo foi publicado em alemão em:
- Chem. Unserer Zeit, 2007, 41, 46-55.
DOI: 10. 1002 / ciuz.200700409
and was translated by W. E. Russey.
Outros artigos por Klaus Roth, publicado pela revista ChemViews:
- No Espresso — Um de Três etapas de Preparação de
Klaus Roth prova de que nenhuma obra-prima culinária pode ser alcançado sem um conhecimento básico de química
DOI: 10.1002/chemv.201000003 - In Chocolate-The Noblest Polymorphism
Klaus Roth proves only chemistry is able to produce such a celestial pleasure
DOI: 10.1002 / chemv.201000021 - em vinho espumante, Champagne & Co
Klaus Roth mostra que só a química pode ser este formigueiro
DOI: 10.1002/chemv.201000047 - Na Farmácia Medo de o Fugu
Klaus Roth mostra a farmácia medo de o fugu ou baiacu estende-se até o distintivo e intrigante poision realiza
DOI: 10.1002/chemv.201000104