- Wie kann ein winziges Molekül wie Ethanol die Ursache für so viel menschliches Elend sein?Hier schlagen wir vor, den chemischen Folgen einer Nacht des Feierns im Übermaß auf den Grund zu gehen.
- 2.1 Ethanolstoffwechsel
- Ethanol ⇒ Acetaldehyd
- Acetaldehyd ⇒ Essigsäure
- 2.2 Zusätzliche metabolische Veränderungen
- Prof. Klaus Roth
Wie kann ein winziges Molekül wie Ethanol die Ursache für so viel menschliches Elend sein?
Hier schlagen wir vor, den chemischen Folgen einer Nacht des Feierns im Übermaß auf den Grund zu gehen.
2.1 Ethanolstoffwechsel
Ethanol (CH3CH2OH) wird in der Leber zu Acetaldehyd (CH3CHO, ethanal) oxidiert, der in einem zweiten Schritt weiter zu Essigsäure (CH3COOH, Ethansäure) oxidiert wird (Abb. 2). Die Essigsäure wird schließlich im Zitronensäurezyklus zu Kohlendioxid und Wasser abgebaut .
Ethanol liefert dabei eine beträchtliche Energiemenge: 450 kcal / 100 g, ein Wert zwischen Glukose (400 kcal / 100 g) und Fett (930 kcal / 100 g). Alkoholische Getränke müssen daher zu den Lebensmitteln gezählt werden.
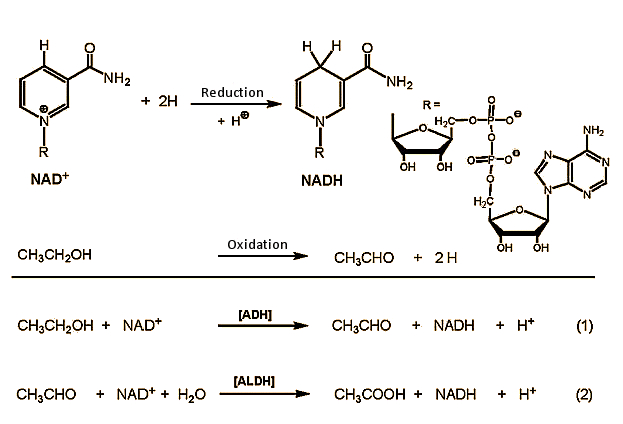
Abbildung 2. Ethanolstoffwechsel im Körper.
Ethanol ⇒ Acetaldehyd
Im ersten Schritt wird Ethanol in Zellen der Leber mit NAD+ (Nicotinamidadenindinukleotid) als Oxidationsmittel zu Acetaldehyd oxidiert. Diese Reaktion wird durch Alkoholdehydrogenase (ADH) -Enzyme katalysiert , von denen der menschliche Körper viele zur Verfügung hat. Sie sind alle strukturell sehr ähnlich und bestehen immer aus zwei Untereinheiten, die jeweils 374 Aminosäuren enthalten. Die α-, β- und γ-Untereinheiten, die für die Ethanoloxidation geeignet sind, sind in drei Genen in unserem Chromosom 4 kodiert und können nach Belieben mit einem der sechs ADH-Dimere (αα, ββ, γγ, αβ, αγ, βγ) kombiniert werden. Die katalytischen Aktivitäten der verschiedenen Kombinationen unterscheiden sich nur geringfügig.
Daneben existieren auch verschiedene Varietäten der β- und γ-Untereinheiten. ADH mit β1-Untereinheiten — häufig bei Europäern – oxidiert ca. 110 mg Ethanol pro Stunde und kg Körpergewicht, während die bei Asiaten häufiger vorkommende β2-Version mit 130 mg / kg / h deutlich katalytischer aktiv ist.
Chronischer Alkoholmissbrauch induziert in Leberzellen eine hochgradige Regulation eines normalerweise untergeordneten Mechanismus der Ethanoloxidation: des mikrosomalen Ethanoloxidationssystems (MEOS). In diesem Fall wird verstärkt eine spezielle Cytochrom-P450-Monooxygenase synthetisiert, die wiederum Ethanol unabhängig von ADH metabolisiert. In der MEOS-Reaktionssequenz wird Ethanol direkt durch molekularen Sauerstoff oxidiert, d.h. es gibt keine energetische Kopplung an die Atmungskette in den Mitochondrien. Energie, die durch MEOS-Oxidation von Ethanol freigesetzt wird, wird einfach in Form von Wärme verworfen und — im Gegensatz zum „normalen“ ADH—Stoffwechsel – nicht chemisch gespeichert.
Dies konnte am Menschen eindrucksvoll nachgewiesen werden: In einer kontrollierten Studie wurde die normale tägliche Kalorienzufuhr mit einer zusätzlichen Menge Ethanol oder Schokolade verdoppelt. Das Ergebnis: Mit Ethanol blieb das Körpergewicht nach zwei Wochen unverändert, aber Schokoladenfresser nahmen 3 kg zu .
Acetaldehyd ⇒ Essigsäure
Zwei Aldehyddehydrogenasen (ALDHs) stehen zur weiteren Oxidation von Ethanol bereit. Eine schnelle Oxidation ist ebenfalls wichtig, da Acetaldehyd giftig ist. Die ALDHs erfüllen ihre Aufgabe beispielhaft: Toxischer Acetaldehyd wird auf zwei Wegen zu unschädlicher Essigsäure oxidiert: Ein kleiner Anteil wird in Leberzellen im Cytosol durch Aldehyddehydrogenase ALDH1 oxidiert, während der Hauptanteil in den Mitochondrien durch ALDH2 oxidiert wird.
Bei der Oxidation sowohl von Alkohol als auch von Acetaldehyd ist NAD+ (Nicotinamidadenindinukleotid) das eigentliche Oxidationsmittel. Die Blutkonzentration von Acetaldehyd bleibt im Allgemeinen unter 2 µmol / l, verglichen mit einer typischen Ethanolkonzentration von 5 mmol / l.
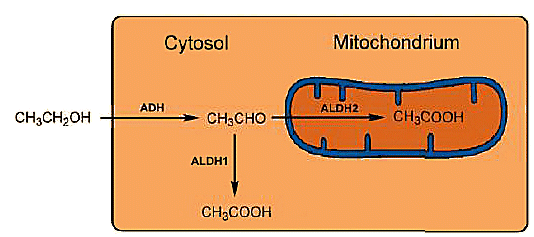
Abbildung 3. Intrazellulärer Metabolismus von Ethanol.
Jedes ALDH besteht aus vier identischen Untereinheiten mit jeweils 500 Aminosäuren, die im Falle von ALDH1 — im Cytosol gefunden — auf Chromosom 9 lokalisiert sind, während ALDH2 aus den Mitochondrien auf Chromosom 12 lokalisiert ist. Die Sequenzkorrespondenz zwischen den beiden ALDHs beträgt nur 68 %, und ihre katalytischen Wirkungen unterscheiden sich entsprechend: ALDH2 aus den Mitochondrien ist viel aktiver als ALDH1 aus dem Cytosol (Abb. 3).
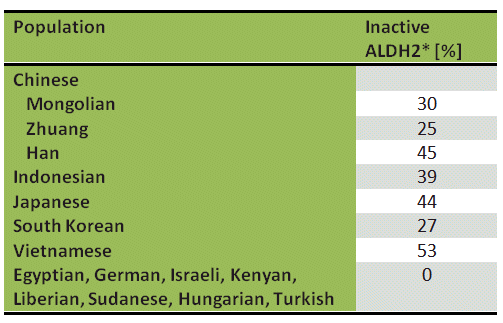
Die ungewöhnliche Alkoholempfindlichkeit eines Teils der Weltbevölkerung, insbesondere aus Asien, ist auf ein verändertes ALDH2 zurückzuführen. Im Gegensatz zu Europäern und Afrikanern sind 44 % der Japaner (Tab. 1) haben eine ALDH2-Enzymvariante in den Mitochondrien ihrer Leberzellen. Diese Modifikation trägt die Bezeichnung ALDH2*, wobei eine Glutaminsäure an Position 487 durch ein Lysin ersetzt wurde. Die Mutation ist katalytisch inaktiv, und Menschen mit ALDH2 * können Acetaldehyd nur langsam metabolisieren, indem sie den weniger aktiven ALDH1-Weg verwenden.
Die Folge: Innerhalb weniger Minuten nach Ethanolkonsum steigt ihre Blut-Acetaldehyd-Konzentration dramatisch an. Während bei einem Europäer (ALDH2) mit einem Blutalkoholgehalt von 0,5 ‰ der Acetaldehydgehalt im Blut unter 2 µmol/l bleibt, kann dieser Wert bei einem Japaner mit ALDH2* 35 µmol/l erreichen.
Acetaldehyd hat eine starke gefäßerweiternde Wirkung, die dazu führt, dass das Gesicht rot wird oder „errötet“ (Flushing-Syndrom). Gleichzeitig treten heftige katerähnliche Symptome auf (Kopfschmerzen, Zittern, Unwohlsein) .
Tabelle 1. Prävalenz der inaktiven Aldehyddehydrogenase (ALDH2 *) in verschiedenen ethnischen Populationen .
Die gleichen Symptome werden bei Patienten mit aktivem ALDH2 beobachtet, wenn das Enzym blockiert wird. Dieser Effekt kann mit dem pharmazeutischen Präparat Antabuse®, einer Verbindung, die ALDH2 vollständig blockiert, nach Belieben induziert werden. Der daraus resultierende Anstieg der Acetaldehydkonzentration mit den damit einhergehenden schwerwiegenden Katersymptomen plagt Drogenabhängige im Entzugstadium, die sich nach Alkoholgenuss einer Behandlung unterziehen.
In ähnlicher Weise sollte man nach dem Genuss eines Gerichts, das zufällig den Pilz Coprinus atramentarius enthält, der allgemein als „Common Ink Cap“ oder „Tippler’s bane“ bekannt ist, in den nächsten drei Tagen alle alkoholischen Getränke strikt meiden (Abb. 4). Andernfalls entwickeln sich nach nur wenigen Minuten schwerwiegende Katersymptome wie Hitzewallungen, Herzklopfen und erhöhter Puls, Kopfschmerzen, Übelkeit, Erbrechen, Schwitzattacken und Zittern der Gliedmaßen. Besonders schwere Fälle können sogar zum Kollaps führen . Dieses Krankheitsbild ist als Coprinus-Syndrom bekannt. Es kann mehrere Stunden andauern, obwohl bisher keine Todesfälle registriert wurden.
.gif)
Abbildung 4. Coprinus-Syndrom.
Die Ursache des Coprinus-Syndroms ist eine stark erhöhte Blut-Acetaldehyd-Konzentration aufgrund einer Komponente des Pilzes, die die Oxidation von Acetaldehyd zu Essigsäure blockiert. Die beobachteten Symptome sind identisch mit denen, die nach Alkoholkonsum während der Behandlung mit Antabuse (Disulfiram) beobachtet wurden . Der Schuldige kann Coprin, N5- (1-hydroxycyclopropyl) -L-glutamin (2) sein, das aus diesem Pilz isoliert wurde . In jüngerer Zeit wurde gezeigt, dass nicht Coprin selbst die Aldehyddehydrogenase ALDH2 blockiert und dadurch die Symptome hervorruft, sondern einer seiner Metaboliten, wahrscheinlich 1-Aminocyclopropanol (3) oder das Hydrat von Cyclopropanon (4) .
2.2 Zusätzliche metabolische Veränderungen
Ethanol und sein Abbau — letzterer verläuft mit halsbrecherischer Geschwindigkeit — führen zu physiologischen Veränderungen, die weit über die Dauer der Intoxikation hinaus anhalten. Aus chemischer Sicht ist Ethanol ein kalorienreiches Reduktionsmittel, dessen Verarbeitung erhebliche Mengen des Oxidationsmittels NAD+ verschlingt und das NAD+/NADH-Verhältnis von 4:1 auf 2:1 senkt. Diese Absenkung des Oxidationspotentials der Zelle bewirkt eine massive und weitreichende Veränderung des Stoffwechsels, z. B. eine Verringerung der Glukosesynthese, Ansammlung von Milchsäure, erhöhte Produktion von Lipiden und verminderter Abbau von Fetten und Proteinen.
Eine verminderte Glukosesynthese senkt wiederum den Blutzuckerspiegel, was zu einer allgemeinen körperlichen Schwäche führt. Im Falle eines Diabetikers, der an Medikamente gewöhnt ist, kann dies die gefürchtete Hypoglykämie hervorrufen. In der Zwischenzeit kann die Ansammlung von Milchsäure den pH-Wert des Blutes unter 7, 36 senken (Azidose).
Eine erhöhte Fettsäuresynthese zusammen mit einem verminderten Lipid- (Fett-) und Proteinstoffwechsel führt zu einer Fett- und Proteinablagerung in der Leber. Dies ist ein reversibler Prozess bei gelegentlichem Alkoholmissbrauch, führt aber in einer chronischen Situation direkt zu einer „Fettleber“, die zusammen mit weiteren alkoholbedingten Schädigungen des Leberstoffwechsels zu Leberzirrhose oder Karzinom führen kann.
Der Ethanolverbrauch ist jedoch nicht nur mit Nachteilen behaftet. Die Plasmakonzentration von HDL-Cholesterin („gutes Cholesterin“) nimmt zu und die Gerinnungsfähigkeit des Blutes nimmt ab. Beide bieten Schutz vor Herzinfarkt und Schlaganfall , was die geringere Prävalenz tödlicher Kreislauferkrankungen in bestimmten Mittelmeerländern erklären kann (Mittelmeerdiät). Teilweise wird dort aber Rotwein in so großen Mengen konsumiert, dass zwar Koronarerkrankungen und Schlaganfälle seltener sind, dafür aber Lebererkrankungen — von der Fettleber bis zum Karzinom — umso häufiger auftreten.
Wie immer — frei nach Paracelsus — stellt die Mäßigung wohl die goldene Mitte dar.
-
Chemie eines Katers – Alkohol und seine Folgen Teil 1
► Lesen Sie mehr über die Chemie eines Katers in Teil 3
K. Roth, Chem. Unsere Zeit 2005, 39, 348. DOI: 10.1002/ciuz.200590067
Details zur Struktur und zum katalytischen Mechanismus der Ethanoloxidation mit ADH: www.chemie.tu-darmstadt.de/akplenio/moproc/zink/alkoholdehydrogenase / ADH_start.htm
C. S. Lieber, Neu Engl. Dr. Med. 1973, 288, 356. DOI: 10.1056/NEJM197302152880710
Hsu et al., Proc. Natl. Acad. Sci. 1985, 82, 3771. Link
H. W. Goedde, D. P. Argawal, Alkoholismus, Pergamon Presse, New York 1989.
D. Crabb et al., J. Clin. Investieren. 1989, 83, 314. DOI: 10.1172/JCI113875
T. L. Wand et al., J. Stud. Alkohol 2000, 61, 13. Link
D. Michelot, Natürliche Toxine 1992, 1, 73. DOI: 10.1002/nt.2620010203
G. M. Hatfield, J. P. Schaumberg, Lloydia 1975, 38, 489 beschrieben. PMID: 1241098
P. Lindberg et al., Chem. Komm. 1975, 946. DOI: 10.1039/C39750000946
P. Lindberg et al. In : J. Chem. Soc. Perkin ich 1977, 684. DOI: 10.1039/P19770000684
J. S. W. Wiseman, R. H. Abeles, Biochemie 1979, 18, 427. DOI: 10.1021/bi00570a006
K. Roth, Chem. Unsere Zeit 2004, 38, 426. DOI: 10.1002/ciuz.200490092
Prof. Klaus Roth
Freie Universität Berlin, Deutschland.
Der Artikel ist erschienen in:
- Chem. Unsere Zeit, 2007, 41, 46 – 55.
DOI: 10.1002/ciuz.200700409
übersetzt von W. E. Russey.
Weitere Artikel von Klaus Roth erschienen im ChemViews Magazin:
- In Espresso — Eine dreistufige Zubereitung
Klaus Roth beweist, dass kein kulinarisches Meisterwerk ohne Grundkenntnisse der Chemie erreicht werden kann
DOI: 10.1002/chemv.201000003 - In Schokolade – Der edelste Polymorphismus
Klaus Roth beweist, dass nur die Chemie ein solches himmlisches Vergnügen erzeugen kann
DOI: 10.1002/chemv.201000021 - In Schaumwein, Champagner & Co
Klaus Roth zeigt, dass nur Chemie so sein kann.
DOI: 10.1002/chemv.201000047 - In Die Angst des Chemikers vor dem Fugu
Klaus Roth zeigt die Angst des Chemikers vor dem Fugu oder Kugelfisch erstreckt sich bis zu der unverwechselbaren und faszinierenden Poision, die er trägt
DOI: 10.1002 / chemv.201000104