Polykřemičitanů
Orthosilikátový Ion, SiO44 –
orthosilikátový ion není přítomen v široké škále minerálů. Je to velmi silná báze, která nebude přetrvávat ve vodném roztoku. V přírodě se nachází v kombinaci s kyselými kationty v nerozpustných solích.
| |
||
| phenacite | Be2SiO4 |   |
| willemite | Zn2SiO4 |   |
| zirkon | ZrSiO4 |   |
| granát | (M2+)3(M3+)2(SiO4)3 | M2+ = Ca, Mg, Fe M3+ = Al, Cr, Fe |
Oligomerní Polykřemičitanů
Polymerní silikátové struktury vyžadují přemostění (2-koordinovat) kyslíky. Aby se vytvořil prostor pro přemostění kyslíku, musí být z „přijímacího“ křemíku odstraněn oxid.
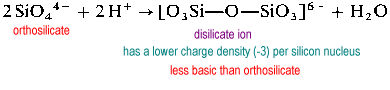
disilikátový ion je v přírodě neobvyklý. Nachází se pouze ve vzácném minerálu thortveitite, Sc2Si2O7. Větší struktury, jako je trisilikát a tetrasilikát, jsou extrémně rychlé.
cyklické oligomerní Polysilikáty
namísto vytváření struktur s dlouhým otevřeným řetězcem budou konce řetězců spojovat eliminující oxidové ionty.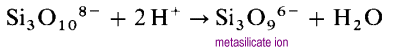
metasilikátový ion je oligomer neznámého sio32-iontu. V těchto strukturách má každý křemík dva přemostění a dva koncové atomy kyslíku. Na atom křemíku je hustota náboje -2. Nejběžnějšími cyklickými polysilikáty jsou cyklické trimery (SiO3)36-a cyklické hexamery (SiO3)612 -.
cyklický trimer se nachází v minerálu benitoit, BaTi (Si3O9.

Řetězce Polykřemičitanů
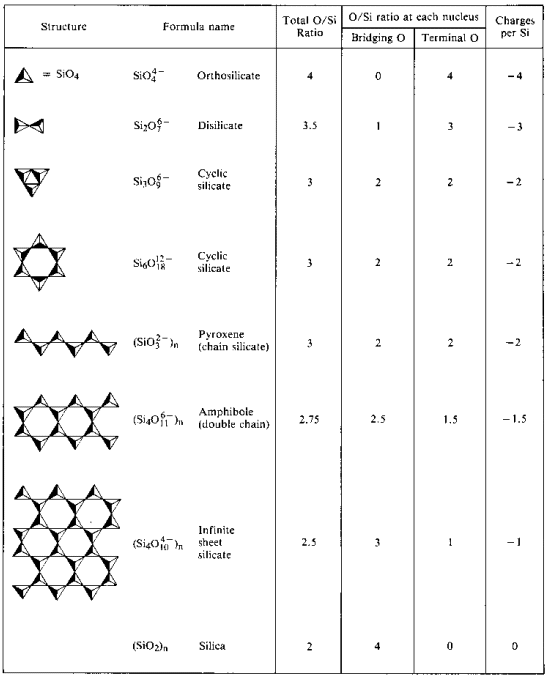
Lineární (1-D) polymery vzorec (SiO3)n2n – mohou být vytvořeny pomocí přemostění kyslíky. V těchto strukturách je náboj -2 na atom křemíku. Skupina minerálů zvaná pyroxenové minerály má tento typ struktury.
| |
|
| enstatite | MgSiO3 |
| diopsite | CaMgSi2O6 |
| spodimene | LiAlSi2O6 |
| pollucite | CsAlSi2O6 |
Lineární řetězce mohou být spojeny side-by-side, jestli oxid ion je nahrazen jiným překlenovací atom kyslíku. Pokud k tomuto propojení dojde u alternativních skupin SiO3 v každém řetězci, výsledkem je struktura s dvojitým řetězcem (Si4O11)n6n. V takových strukturách dochází ke snížení náboje a počtu atomů kyslíku na atom křemíku.
Krocidolit, azbestový minerál vzorce NA2FE5 (OH)22, je příkladem. Tento minerál má vláknitou povahu a má vlastnosti odolné proti ohni a teplu, které pramení ze struktury s dlouhým řetězcem aniontu.
List Polykřemičitanů
Když se ze strany na stranu, propojení řetězů je i nadále na dobu neurčitou, více oxidy jsou odstraněny a 2-D polymer výsledky. Tyto 2 – D polymery se nazývají křemičitany listů a obsahují N4N-anion. Minerály obsahující tuto strukturu se snadno štěpí na tenké plechy.
| |
|
| micas | muskovit a biotit |
| jílové minerály | montmorillonit, kaolinit, čína hlíny a vermikulit |
| mastek |   |
| mastek |   |
| chrysotilového azbestu |   |
3-D Polymerní Křemičitany
Listy jsou spojeny do 3-D, polymer, když všechny oxidové ionty jsou eliminovány (všechny okysličovadla v konstrukci jsou přemostěna). Tato struktura obsahuje nenabitý oxid křemičitý n, který již není zásaditý, ale spíše kyselý oxid. Mnoho běžných minerálů obsahuje tuto strukturu: křemen, pazourek, jaspis, onyx, Ametyst, Citrin, achát a chalcedon.
Postupná polymerace takto:
- Následek postupné snížení O/Si atom poměr
- 4:1 v orthosilicate
- 2:1 v křemičitého

 Umístěte následující minerály v pořadí rostoucí stupeň polymerace. Za tímto účelem Vypočítejte poměr O/Si (čím nižší je poměr, tím polymerizovanější je struktura.
Umístěte následující minerály v pořadí rostoucí stupeň polymerace. Za tímto účelem Vypočítejte poměr O/Si (čím nižší je poměr, tím polymerizovanější je struktura.
- pyrophyllite, Al2Si4O10(OH)2
- grunerite, Fe7Si8O22(OH)2
- spessartite, Mn3Al2Si3O12
- bustamite, CaMn(SiO3)2
Sklo
Když kyselý oxid křemičitý se nechá reagovat se základními oxidů při velmi vysokých teplotách (~1700 0C) a pak se ochladí příliš rychle pro polysilikátu ionty umožňují fomation řádné polysilikátu ionty našel na minerály tvoří. Výsledkem je vytvoření amorfní pevné látky nebo skla. Brýle se vyznačují tím, že nemají určitý bod tuhnutí.
jednoduché sklo se vyrábí tavením (tavením) písku s hydrogenuhličitanem sodným a vápenec (zdroje základních oxidů Na2O a CaO). Během tohoto procesu jsou mosty křemík-kyslík přerušeny.
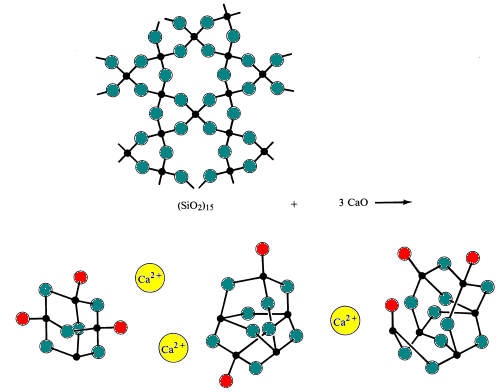
Speciální brýle jsou vyrobeny změnou složení kyselých a základních oxidů ve skle.
- sklo Pyrex ™ je neobvykle odolné vůči tepelnému šoku. Aby se dosáhlo 10-25% B2O3, je do struktury začleněn kyselý oxid.
- Barevné brýle začlenit d-blok oxidy kovů jako součást základního oxid složka
- Začlenění stroncium oxid dává skla, které absorbuje x-paprsky emittd podle barvy televizory
- jemné optické vlastnosti potřebné ve čočky fotoaparátu může být získán tím, že začlenění La2O3
Dozvědět se více o brýle a v Corning Museum Sklo Zdroj stránky.
Půdní Chemie
skutečnost, že stále více polymerované polysilikátu ionty mají klesající poplatky za křemíku, který výsledky v snížila basicity má takové důsledky v půdní chemii.
více základní polysilikátu anion minerální snadněji, to bude reagovat s slabé kyseliny a podstoupit povětrnostním vlivům.
dešťová voda je poněkud kyselá díky rozpuštěnému CO2 i v nepřítomnosti oxidů síry a dusíku.
v průběhu času bude dešťová voda reagovat s méně polymerovanými silikátovými anionty, aby nahradila oxidové ionty přemostěním kyslíku, čímž se získá vysoce polymerovaný křemičitan. Oxidy se odstraňují jako molekuly vody.
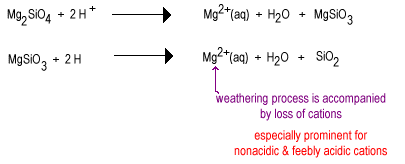
mezistupeň zvětrávání má velké množství vrstvových silikátů, jako je jíl, stejně jako nějaký křemen. Tyto půdy se obvykle nacházejí v mírných oblastech pod krytem trávy nebo stromů. Tyto půdy jsou méně úrodné než nově zavlažované pusté půdy kvůli ztrátě nekyselé rostlinné živiny k+. Vrstvy křemičitany přítomné v mezilehlých půdách mohou stále držet kationty na jejich záporně nabitých površích, které mohou být uvolněny, jak je rostlina potřebuje. Tyto půdy se nacházejí v stále poměrně úrodných kukuřičných a pšeničných pásech.
izomorfní substituce
Polysilikátové ionty mají záporné náboje, které musí být vyváženy vhodnými kationty. Terminální kyslíky mají záporně nabité povrchy, které přibližují těsně zabalené povrchy záporného náboje. Kationty, které jsou potřebné k neutralizaci polysilikátu negativní náboj, jsou umístěny ve vrstvách mezi řetězy nebo vrstvy nebo v tetraedrické nebo oktaedrická otvory přítomen v 3-D mříži.
typy kationtů nalézt v konkrétní podobě polysilikátu, bude záviset na“
- velikost kationtů
- náboj kationtů
Od té doby poměrně málo sady ionty existují, které mají stejný náboj a velmi podobné poloměry, tam je malý důvod pro jeden z těchto uzavřeno typy iontů být upřednostňována před jinou, když minerál je tvořen na chlazení roztavené magma.
například olivín, který má ideální složení Mg2SiO4, může obsahovat různé podíly isomorfní subtitution z Fe2+ radius (92 hodin) v místě stejný počet Mg2+ ionty (poloměr 86 pm).
První Zásada Isomorfní Subsititution
Druhý Princip Isomorfní Substituce
izomorfní substituce zvyšuje počet možných substitucí v silikátech.
Příklady
- K+může být nahrazen vzácné Rb+ a Tl+ iontů, stejně jako společné Ba2+
- Ca2+mohou být nahrazeny Sr2+(132 hodin), Na+(116 pm), Y3+(104 hodin), La3+ (117 pm), a šestý-období f-blok ionty (100-117 pm)
- Si4+ může být nahrazen společným Al3+ iontů (67 pm)
kationty ve většině silikátových minerálů jsou značně substituované který dělá non-ekonomické rud pro většinu prvků. Existují diagonální vztahy prvků (zejména ve druhé třetině) k prvkům jedna skupina vpravo a jedna perioda dole na stole.
 Který z následujících minerálů může vzniknout tím, že isomorfní substituce procesů v leucite, K(AlSi2O6)?
Který z následujících minerálů může vzniknout tím, že isomorfní substituce procesů v leucite, K(AlSi2O6)?
- K(YSi2O6)
- Rb(AlSi2O6)
- Ba(BeSi2O6)
- Ba(AlSi2O6)
TIP: Existují dva základní principy iontových sloučenin, které musí být dodrženy v isomorfní substituce:
- celkový náboj všech kationtů se musí rovnat celkové zatížení všech aniontů.
- aby pro substituční být isomorfní, celkový počet kationtů bude v musí být přibližně rovna celkové zatížení všech kationtů nahrazena.