Polysilikater
Orthosilicate Ion, SiO44 –
orthosilicate ion er ikke til stede i et bredt utvalg av mineraler. Det er en veldig sterk base som ikke vil vedvare i vandig løsning. I naturen finnes det i kombinasjon med sure kationer i uoppløselige salter.
| |
||
| fenacitt | Be2SiO4 | & nbsp |
| willemite | Zn2SiO4 | & nbsp |
| zirkon | ZrSiO4 | & nbsp |
| granat | (M2+) 3 (M3+) 2(SiO4) 3 | M2 + = Ca, Mg, Fe M3+ = Al, Cr, Fe |
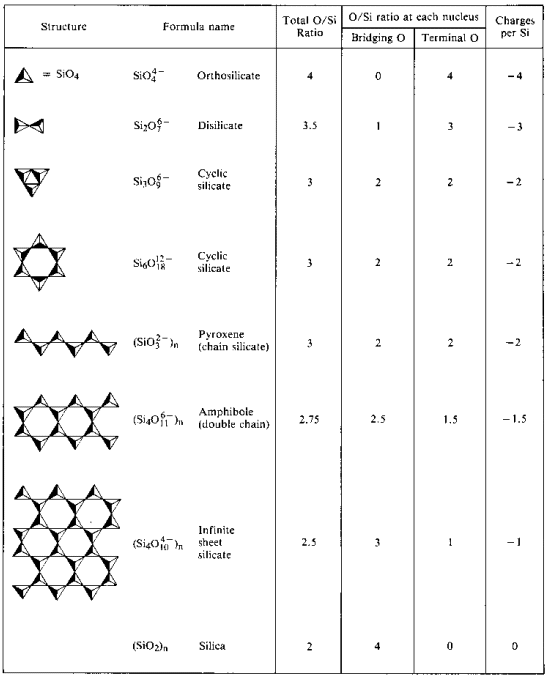
Oligomere Polysilikater
Polymere silikatstrukturer krever brobygging(2-koordinat) oksygen. For å gjøre plass til en bro oksygen, må et oksid fjernes fra» mottak » silisium.
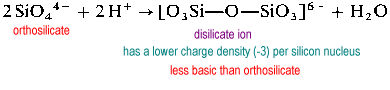
disilikatjonen er uvanlig i naturen. Den finnes bare I det sjeldne mineralet thortveitite, Sc2Si2O7. Større strukturer som trisilikat og tetrasilikat er ekstremt rate.
Sykliske Oligomere Polysilikater
I Stedet for å danne lange åpne kjedestrukturer, vil endene av kjedene knytte eliminere oksidioner.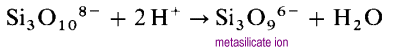
metasilikatjonen er en oligomer av det ukjente SiO32-ion. I disse strukturene har hver silisium to broer og to terminale oksygenatomer. Det er en -2 ladetetthet per silisiumatom. De vanligste sykliske polysilikatene er de sykliske trimrene (SiO3) 36-og de sykliske heksamrene(SiO3)612 -.
den sykliske trimer finnes i mineralet benitoitt, BaTi (Si3O9.

Kjede Polysilikater
Lineære (1-D) polymerer med formel (SiO3) n2n – kan dannes via brooksygener. I disse strukturene er det en ladning på -2 per silisiumatom. En gruppe mineraler kalt pyroksenmineraler har denne typen struktur.
| |
|
| enstatitt | MgSiO3 |
| diopsite | CaMgSi2O6 |
| spodimene | LiAlSi2O6 |
| pollucitt | CsAlSi2O6 |
Lineære kjeder kan knyttes side om side hvis et oksidion erstattes med et annet brodannende oksygenatom. Hvis denne koblingen skjer ved alternative sio3-grupper i hver kjede, resulterer en dobbeltkjedestruktur (Si4O11)n6n -. I slike strukturer er det en reduksjon i ladningen og antall oksygenatomer per silisiumatom.
Krokidolitt, et asbestmineral med Formel Na2Fe5 (OH) 22, er et eksempel. Dette mineralet er fibrøst i naturen og har brann – og varmebestandige egenskaper som stammer fra anionens lange kjedestruktur.
Arkpolysilikater
når side-til-side-kobling av kjeder fortsettes på ubestemt tid, elimineres flere oksider og en 2-d-polymer resulterer. Disse 2-d polymerer kalles arksilikater og inneholder n4n-anion. Mineraler som inneholder denne strukturen spaltes lett i tynne ark.
| |
|
| micas | muskovitt og biotitt |
| leire mineraler | montmorillonitt, kaolinitt, kina leire og vermikulitt |
| talkum | & nbsp |
| kleberstein | & nbsp |
| krysotil asbest | & nbsp |
3-D Polymere Silikater
Ark er koblet til en 3-D polymer når alle oksydioner elimineres (alle oksygen i strukturen er bro). Denne strukturen inneholder uladet oksid silika n som ikke lenger er grunnleggende, men heller et surt oksid. Mange vanlige mineraler inneholder denne strukturen: kvarts, flint, jaspis, onyx, ametyst, citrin, agat og chalcedon.
Suksessive polymerisasjonstrinn:
- Resulterer i suksessiv reduksjon Av O / Si-atomforhold
- 4:1 i ortosilikat
- 2:1 i silika

 Plasser følgende mineraler i rekkefølge av økende grad av polymerisering. For å gjøre dette, beregne o/Si-forholdet (jo lavere forholdet jo mer polymerisert strukturen.
Plasser følgende mineraler i rekkefølge av økende grad av polymerisering. For å gjøre dette, beregne o/Si-forholdet (jo lavere forholdet jo mer polymerisert strukturen.
- pyrofyllitt, Al2Si4O10(OH)2
- gruneritt, Fe7Si8O22 (OH)2
- spessartitt, Mn3Al2Si3O12
- bustamitt, CaMn(SiO3)2
Glass
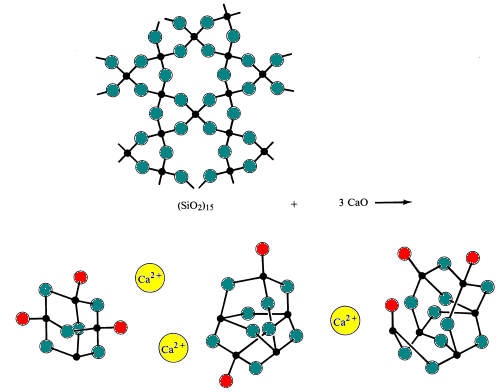
når sur silika er reagert med grunnleggende oksider ved svært høye temperaturer (~1700 0C) og deretter avkjølt for raskt for polysilicate ioner å tillate fomation av ryddig polysilicate ioner funnet i mineraler for å danne. Resultatet er dannelse av et amorft fast stoff eller glass. Briller er preget av å ikke ha noe bestemt frysepunkt.
Enkelt glass er laget ved å smelte (fusjonere) sand med natriumbikarbonat og kalkstein(kilder Til de grunnleggende oksider Na2O Og CaO). Under denne prosessen brytes silisium-oksygenbroer.
Spesialbriller er laget ved å endre sammensetningen av sure og basiske oksider i glasset.
- Pyrex ™ glass er uvanlig motstandsdyktig mot termisk sjokk. For å gjøre det 10-25% B2O3, et surt oksid, inkorporeres i strukturen.
- Fargede briller innlemme d-blokk metalloksider som en del av den grunnleggende oksid komponent
- Inkorporering av strontium oksid gir et glass som absorberer x-stråler emittd av farge-TV-apparater
- de fine optiske kvaliteter som trengs i kameralinser kan fås ved inkorporering Av La2O3
Lær mer om briller her og På Corning Museum Glass Ressurs nettsted .
Jord Kjemi
det faktum at stadig polymerisert polysilicate ioner har avtagende kostnader per silisium som resulterer i senket basicity har importan konsekvenser i jord kjemi.
jo mer grunnleggende polysilikatanionen av et mineral er, desto lettere vil det reagere med svake syrer og gjennomgå forvitring.
Regnvann er noe surt på grunn AV oppløst CO2 selv i fravær av svovel – og nitrogenoksider.
over tid vil regnvann reagere med de mindre polymeriserte silikatanioner for å erstatte oksidioner med brooksygener som gir et mer polymerisert silikat. Oksydene fjernes som vannmolekyler.
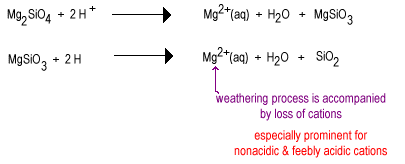
mellomstadiet av forvitring har store mengder lagsilikater som leire, samt noen kvarts. Disse jordene har en tendens til å bli funnet i tempererte områder under et dekke av gress eller trær. Slike jordarter er mindre fruktbare enn nyvannede deserjord på grunn av tap Av det ikke-sure plantenæringsstoffet K+. Lagsilikater til stede i mellomjord kan fortsatt holde kationer på deres negativt ladede overflater som kan frigjøres når planten trenger dem. Disse jordene finnes i de fortsatt ganske fruktbare mais-og hvetebeltene.
Isomorf Substitusjon
Polysilikationer har negative ladninger som må motvirkes av passende kationer. De terminale oksygenene har negativt ladede overflater som tilnærmer nærpakkede overflater med negativ ladning. Kationene som trengs for å nøytralisere polysilikatets negative ladning befinner seg i lagene mellom kjedene eller lagene eller i de tetraedrale eller oktaedrale hullene som er tilstede i 3-D gitteret.
typene kationer som finnes i en bestemt form for polysilikat vil avhenge av»
- størrelsen på kationene
- ladningen av kationene
Siden ganske mange sett med ioner eksisterer som har samme ladning og svært lignende radier, er det liten grunn til at en av disse samsvarende typer ioner skal foretrekkes over en annen når et mineral dannes ved avkjøling av smeltet magma.
for eksempel olivin, som har en ideell sammensetning Av Mg2SiO4, kan inneholde varierende prosenter av isomorf teksting Av Fe2+ (radius 92 pm) i stedet for et like antall Mg2 + – ioner (radius 86 pm).
Første Prinsipp For Isomorf Subsititusjon
Andre Priciple Av Isomorf Substitusjon
Isomorf substitusjon øker antall mulige substitusjoner i silikater.
Eksempler
- K+kan erstattes av de sjeldne Rb+-og Tl+-ionene, samt de vanlige Ba2+
- Ca2+kan erstattes Av Sr2+(132 pm), Na+(116 pm), Y3+(104 pm), La3+ (117 pm) og de sjette perioden f-blokkioner (100-117 pm)
- Si4+ Kan Erstattes Av Den Vanlige Al3+ Ion (67 pm)
kationene I De Fleste Silikatmineraler Er Omfattende Erstattet Som Gjør Ikke-Økonomiske Malmer For De Fleste elementer. Det er diagonale relasjoner av elementer (spesielt i den andre perioden) til elementene en gruppe til høyre og en periode ned på bordet.
 Hvilke av følgende mineraler kan oppstå ved isomorf substitusjonsprosesser i leucitt, K (AlSi2O6)?
Hvilke av følgende mineraler kan oppstå ved isomorf substitusjonsprosesser i leucitt, K (AlSi2O6)?
- K(YSi2O6)
- Rb(AlSi2O6)
- Ba(BeSi2O6)
- Ba(AlSi2O6)
HINT: det er to grunnleggende prinsipper for ioniske forbindelser som må observeres ved isomorf substitusjon:
- den totale ladningen av alle kationer må være lik den totale ladningen av alle anioner.
- for at substitusjonen skal være isomorf, må det totale antall kationer som går inn, være omtrent lik den totale ladningen av alle kationene som erstattes.