Polisilicati
Lo Orth ortosilicato, SiO44 –
Lo ion ortosilicato non è presente in un’ampia varietà di minerali. È una base molto forte che non persisterà in soluzione acquosa. In natura si trova in combinazione con cationi acidi in sali insolubili.
| |
||
| fenacite | Be2SiO4 |   |
| willemite | Zn2SiO4 |   |
| zircone | ZrSiO4 |   |
| granato | (M2+)3(M3+)2(SiO4)3 | M2+ = Ca, Mg, Fe M3+ = Al, Cr, Fe |
Oligomerici Polysilicates
Polimerici silicato di strutture di raccordo (2-coordinate) oxygens. Per fare spazio a un ossigeno ponte, un ossido deve essere rimosso dal silicio” ricevente”.
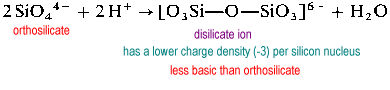
Lo ion disilicato è raro in natura. Si trova solo nel raro minerale thortveitite, Sc2Si2O7. Strutture più grandi come il trisilicato e il tetrasilicato sono estremamente veloci.
Polisilicati oligomerici ciclici
Invece di formare lunghe strutture a catena aperta, le estremità delle catene si collegheranno eliminando gli ioni di ossido.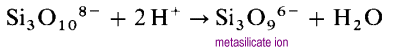
Lo met metasilicato è un oligomero dello sconosciuto ion SiO32. In queste strutture ogni silicio possiede due atomi di ossigeno a ponte e due terminali. C’è una densità di carica -2 per atomo di silicio. I polisilicati ciclici più comuni sono i trimeri ciclici (SiO3)36 – e gli esameri ciclici (SiO3)612-.
Il trimero ciclico si trova nel minerale benitoite, BaTi (Si3O9.

Polisilicati a catena
Polimeri lineari (1-D) di formula (SiO3)n2n – possono essere formati tramite ossigeni a ponte. In queste strutture c’è una carica di -2 per atomo di silicio. Un gruppo di minerali chiamati minerali pirossenici ha questo tipo di struttura.
| |
|
| enstatite | MgSiO3 |
| diopsite | CaMgSi2O6 |
| spodimene | LiAlSi2O6 |
| pollucite | CsAlSi2O6 |
catene Lineari possono essere collegati side-by-side se un ossido di ioni viene sostituito con un altro di raccordo atomo di ossigeno. Se questo collegamento si verifica in gruppi SIO3 alternativi in ogni catena, una struttura a doppia catena (Si4O11)n6n-risultati. In tali strutture c’è una riduzione della carica e del numero di atomi di ossigeno per atomo di silicio.
La crocidolite, un minerale di amianto di formula Na2Fe5(OH)22, ne è un esempio. Questo minerale è fibroso in natura ed ha fuoco e proprietà termoresistenti che deriva dalla struttura a catena lunga dell’anione.
Polisilicati di fogli
Quando il collegamento laterale delle catene viene continuato indefinitamente, vengono eliminati più ossidi e si ottiene un polimero 2D. Questi polimeri 2-D sono chiamati silicati di fogli e contengono l’anione n4n. I minerali contenenti questa struttura sono facilmente scissi in fogli sottili.
| |
|
| miche | muscovite e biotite |
| minerali argillosi | montmorillonite, caolinite, cina argilla e vermiculite |
| talco |   |
| pietra ollare |   |
| l’amianto crisotilo |   |
3-D Polimerici Silicati
Fogli sono collegati in un 3-D polimero quando tutti gli ioni di ossido eliminano tutti gli ossigeni nella struttura stanno colmando). Questa struttura contiene silice n di ossido non caricata che non è più basica ma piuttosto un ossido acido. Molti minerali comuni contengono questa struttura: quarzo, selce, diaspro, onice, ametista, citrino, agata e calcedonio.
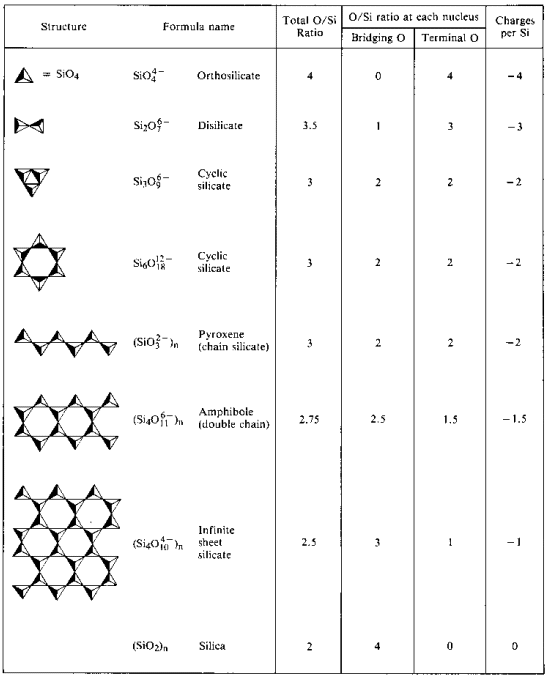
Le fasi successive di polimerizzazione:
- Determinano una riduzione successiva del rapporto atomo O/Si
- 4:1 in ortosilicato
- 2:1 in silice

 Posizionare i seguenti minerali in ordine crescente di grado di polimerizzazione. Per fare ciò, calcolare il rapporto O/Si (più basso è il rapporto più polimerizzata è la struttura.
Posizionare i seguenti minerali in ordine crescente di grado di polimerizzazione. Per fare ciò, calcolare il rapporto O/Si (più basso è il rapporto più polimerizzata è la struttura.
- pirofilite, Al2Si4O10(OH)2
- la grunerite d’, Fe7Si8O22(OH)2
- spessartite, Mn3Al2Si3O12
- bustamite, CaMn(SiO3)2
Vetro
Quando acida di silice è reagito con base di ossidi a temperature molto elevate (~1700 0C) e poi raffreddato troppo rapidamente per il polisilicato di ioni per consentire il fomation di un corretto polisilicato ioni trovato in minerali di forma. Il risultato è la formazione di un solido amorfo o di un vetro. Gli occhiali sono caratterizzati dall’assenza di un punto di congelamento definito.
Il vetro semplice è fatto fondendo (fondendo) sabbia con bicarbonato di sodio e calcare (fonti degli ossidi basici Na2O e CaO). Durante questo processo, i ponti silicio-ossigeno sono rotti.
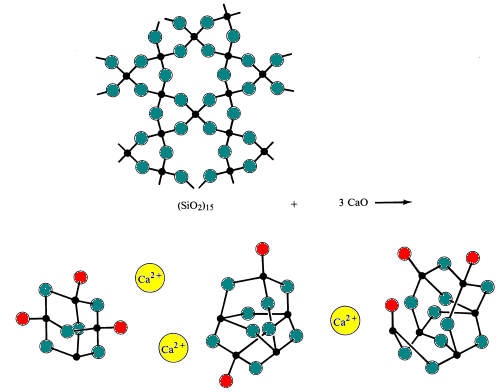
Gli occhiali speciali sono realizzati alterando la composizione di ossidi acidi e basici nel vetro.
- Il vetro Pyrex ™ è insolitamente resistente agli shock termici. Per renderlo 10-25% B2O3, un ossido acido, è incorporato nella struttura.
- Gli occhiali colorati incorporano ossidi metallici d-block come parte del componente ossido di base
- L’incorporazione di ossido di stronzio dà un vetro che assorbe i raggi x emessi dai televisori a colori
- Le qualità ottiche fini necessarie negli obiettivi della fotocamera possono essere ottenute incorporando La2O3
Ulteriori informazioni sugli occhiali qui e presso il sito Glass Resource del Corning Museum.
Chimica del suolo
Il fatto che gli ioni polisilicati sempre più polimerizzati abbiano cariche decrescenti per silicio che si traducono in una bassa basicità ha importanti conseguenze nella chimica del suolo.
Più basico è l’anione polisilicato di un minerale, più facilmente reagirà con acidi deboli e subirà agenti atmosferici.
L’acqua piovana è un po ‘ acida a causa della CO2 disciolta anche in assenza di zolfo e ossidi di azoto.
Nel tempo l’acqua piovana reagirà con gli anioni di silicato meno polimerizzati per sostituire gli ioni di ossido con ossigeno a ponte producendo un silicato più altamente polimerizzato. Gli ossidi vengono rimossi come molecole d’acqua.
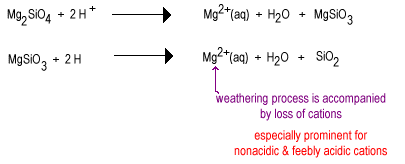
La fase intermedia degli agenti atmosferici ha grandi quantità di silicati di strato come l’argilla e alcuni quarzo. Questi suoli tendono ad essere trovati nelle regioni temperate sotto una copertura di erba o alberi. Tali terreni sono meno fertili dei terreni deserti appena irrigati a causa della perdita del nutriente vegetale non acido K+. I silicati di strato presenti nei terreni intermedi possono ancora contenere cationi sulle loro superfici caricate negativamente che possono essere rilasciati quando la pianta ne ha bisogno. Questi terreni si trovano nelle cinture di mais e grano ancora abbastanza fertili.
Sostituzione isomorfa
Gli ioni polisilicati hanno cariche negative che devono essere controbilanciate da cationi appropriati. Gli ossigeni terminali possiedono superfici caricate negativamente che approssimano le superfici ravvicinate di carica negativa. I cationi necessari per neutralizzare la carica negativa del polisilicato si trovano negli strati tra le catene o gli strati o nei fori tetraedrici o ottaedrici presenti nel reticolo 3-D.
tipi di cationi trovato in una forma particolare di polisilicato dipenderà”
- la dimensione dei cationi
- la carica dei cationi
Dal momento che un bel paio di set di ioni esistono, che hanno la stessa carica e molto simile raggi, non c’è ragione per uno di questi abbinati tipi di ioni di essere preferito rispetto ad un altro quando un minerale che si forma sul raffreddamento del magma fuso.
Ad esempio l’olivina, che ha una composizione ideale di Mg2SiO4, può contenere percentuali variabili di substitution isomorfo di Fe2 + (raggio 92 pm) al posto di un numero uguale di ioni Mg2+ (raggio 86 pm).
Primo principio di Subsititution isomorfo
Secondo principio di sostituzione isomorfa
La sostituzione isomorfa aumenta il numero di possibili sostituzioni nei silicati.
Esempi
- K+può essere sostituito da rari Rb+ Tl+ ioni così come il comune di Ba2+
- Ca2+può essere sostituito da Sr2+(132 pm), Na+(116 pm), Y3+(104 pm), La3+ (117 pm), e il sesto periodo f-blocco ioni (100-117 pm)
- Si4+ può essere sostituito da comune Al3+ ione (67 pm)
cationi nella maggior parte dei minerali silicatici sono ampiamente sostituito il che rende non economici minerali per la maggior parte degli elementi. Ci sono relazioni diagonali di elementi (specialmente nel secondo periodo) agli elementi un gruppo a destra e un periodo in basso sul tavolo.
 Quale dei seguenti minerali potrebbe derivare da processi di sostituzione isomorfa in leucite, K(AlSi2O6)?
Quale dei seguenti minerali potrebbe derivare da processi di sostituzione isomorfa in leucite, K(AlSi2O6)?
- K(YSi2O6)
- Rb(AlSi2O6)
- Ba(BeSi2O6)
- Ba(AlSi2O6)
SUGGERIMENTO: Ci sono due principi fondamentali di composti ionici che devono essere osservate nella isomorfe sostituzione:
- Il costo totale di tutti i cationi deve essere uguale alla carica totale di tutti gli anioni.
- Affinché la sostituzione sia isomorfa, il numero totale di cationi in entrata deve essere approssimativamente uguale alla carica totale di tutti i cationi sostituiti.