- Polisilicatos
- El ion ortosilicato, SiO44 –
- Oligomérica Polysilicates
- Polisilicatos Oligoméricos cíclicos
- Polisilicatos de cadena
- Polisilicatos en hojas
- 3-Las láminas de silicatos poliméricos D
- Vidrio
- Química del suelo
- Sustitución isomórfica
- Primer Principio de Substitución isomórfica
- Segundo principio de Sustitución isomórfica
Polisilicatos
El ion ortosilicato, SiO44 –
El ion ortosilicato no está presente en una amplia variedad de minerales. Es una base muy fuerte que no persistirá en solución acuosa. En la naturaleza se encuentra en combinación con cationes ácidos en sales insolubles.
| |
||
| phenacite | Be2SiO4 |   |
| willemite | Zn2SiO4 |   |
| circón | ZrSiO4 |   |
| granate | (M2+)3(M3+)2(SiO4)3 | M2+ = Ca, Mg, Fe M3+ = Al, Cr, Fe |
Oligomérica Polysilicates
Poliméricos de silicatos exigen la reducción de (2-coordinar) oxígenos. Para hacer espacio para un puente de oxígeno, se debe eliminar un óxido del silicio «receptor».
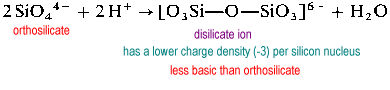
El ion disilicato es poco común en la naturaleza. Se encuentra solo en el raro mineral thortveitite, Sc2Si2O7. Las estructuras más grandes, como el trisilicato y el tetrasilicato, son extremadamente rápidas.
Polisilicatos Oligoméricos cíclicos
En lugar de formar estructuras largas de cadena abierta, los extremos de las cadenas se unirán eliminando los iones de óxido.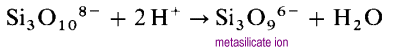
El ion metasilicato es un oligómero del ion SiO32 desconocido. En estas estructuras, cada silicio posee dos átomos de oxígeno terminales y dos de puente. Hay una densidad de carga de -2 por átomo de silicio. Los polisilicatos cíclicos más comunes son los trímeros cíclicos, (SiO3)36 – y los hexámeros cíclicos (SiO3)612-.
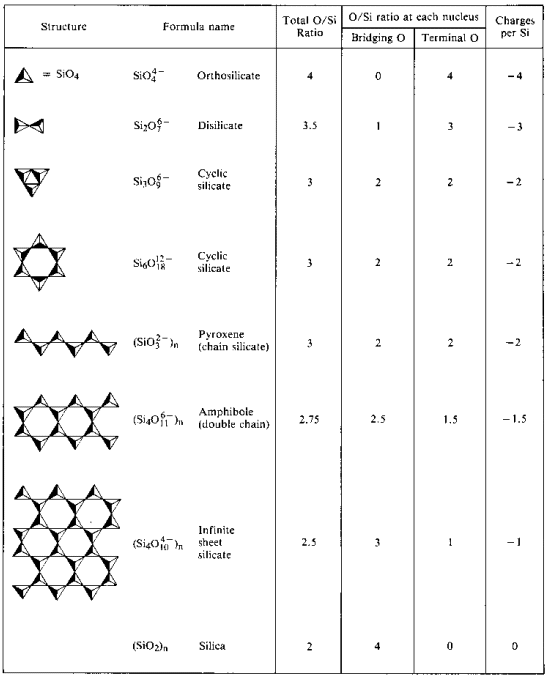
El trímero cíclico se encuentra en el mineral benitoita, BaTi(Si3O9.

Polisilicatos de cadena
Polímeros lineales (1-D) de fórmula (SiO3)n2n – se puede formar a través de oxígenos puente. En estas estructuras hay una carga de -2 por átomo de silicio. Un grupo de minerales llamados minerales de piroxeno tienen este tipo de estructura.
| |
|
| enstatite | MgSiO3 |
| diopsite | CaMgSi2O6 |
| spodimene | LiAlSi2O6 |
| pollucite | CsAlSi2O6 |
cadenas Lineales pueden estar vinculados side-by-side si un óxido de iones es reemplazado con otro puente átomo de oxígeno. Si este enlace ocurre en grupos SiO3 alternativos en cada cadena, se obtiene una estructura de cadena doble (Si4O11)n6n. En tales estructuras hay una reducción en la carga y el número de átomos de oxígeno por átomo de silicio.
La crocidolita, un mineral de amianto de fórmula Na2Fe5 (OH) 22, es un ejemplo. Este mineral es de naturaleza fibrosa y tiene propiedades resistentes al fuego y al calor que se derivan de la estructura de cadena larga del anión.
Polisilicatos en hojas
Cuando el enlace de lado a lado de las cadenas se continúa indefinidamente, se eliminan más óxidos y se obtiene un polímero 2D. Estos polímeros 2-D se llaman silicatos de lámina y contienen el anión n4n. Los minerales que contienen esta estructura se rompen fácilmente en láminas delgadas.
| |
|
| micas | moscovita y biotita |
| minerales de arcilla | montmorillonita, caolinita, arcilla china y vermiculita |
| talco | & nbsp |
| piedra de jabón | & nbsp |
| amianto crisotilo | & nbsp |
3-Las láminas de silicatos poliméricos D
se unen a un polímero 3D cuando se eliminan todos los iones de óxido (todos oxígenos en la estructura son puentes). Esta estructura contiene óxido de sílice n sin carga, que ya no es básico, sino más bien un óxido ácido. Muchos minerales comunes contienen esta estructura: cuarzo, sílex, jaspe, onix, amatista, citrino, ágata y calcedonia.
Pasos sucesivos de polimerización:
- Resultan en una reducción sucesiva de la relación de átomos O / Si
- 4:1 en ortosilicato
- 2:1 en sílice

 Coloque los siguientes minerales en orden de grado creciente de polimerización. Para hacer esto, calcule la relación O/Si (cuanto menor sea la relación, más polimerizada será la estructura.
Coloque los siguientes minerales en orden de grado creciente de polimerización. Para hacer esto, calcule la relación O/Si (cuanto menor sea la relación, más polimerizada será la estructura.
- pirofilita, Al2Si4O10 (OH)2
- grunerita, Fe7Si8O22 (OH)2
- espesartita, Mn3Al2Si3O12
- bustamita, CaMn(SiO3)2
Vidrio
Cuando la sílice ácida reacciona con óxidos básicos a temperaturas muy altas (~1700 0C) y luego se enfría demasiado rápido para que los iones de polisilicato permitan la formación de iones de polisilicato ordenados que se encuentran en los minerales. El resultado es la formación de un sólido amorfo o vidrio. Las gafas se caracterizan por no tener un punto de congelación definido.
El vidrio simple se fabrica fundiendo (fusionando) arena con bicarbonato de sodio y piedra caliza (fuentes de los óxidos básicos Na2O y CaO). Durante este proceso, los puentes silicio-oxígeno se rompen.
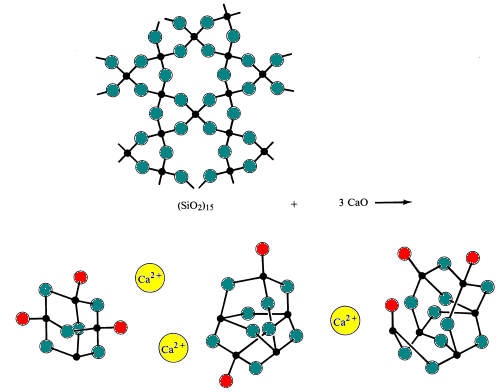
Las gafas especiales se fabrican alterando la composición de óxidos ácidos y básicos en el vidrio.
- El vidrio Pyrex ™ es inusualmente resistente al choque térmico. Para hacerlo, se incorpora a la estructura un 10-25% de B2O3, un óxido ácido.
- Las gafas de colores incorporan óxidos metálicos de bloque D como parte del componente básico de óxido
- La incorporación de óxido de estroncio proporciona un vidrio que absorbe los rayos X emitidos por televisores en color
- Las finas cualidades ópticas necesarias en las lentes de cámara se pueden obtener mediante la incorporación de La2O3
Obtenga más información sobre las gafas aquí y en el sitio de Recursos de vidrio del Museo Corning.
Química del suelo
El hecho de que los iones de polisilicato cada vez más polimerizados tengan cargas decrecientes por silicio, lo que resulta en una basicidad reducida, tiene importantes consecuencias en la química del suelo.
Cuanto más básico sea el anión polisilicato de un mineral, más fácilmente reaccionará con ácidos débiles y se someterá a la intemperie.
El agua de lluvia es algo ácida debido al CO2 disuelto, incluso en ausencia de óxidos de azufre y nitrógeno.
Con el tiempo, el agua de lluvia reaccionará con los aniones de silicato menos polimerizados para reemplazar los iones de óxido con oxígeno puente, produciendo un silicato más polimerizado. Los óxidos se eliminan como moléculas de agua.
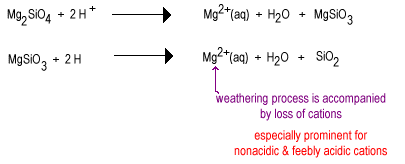
La etapa intermedia de la intemperie tiene grandes cantidades de silicatos de capa, como arcilla, así como algo de cuarzo. Estos suelos tienden a encontrarse en regiones templadas cubiertas de hierba o árboles. Estos suelos son menos fértiles que los suelos de deser recién irrigados debido a la pérdida del nutriente vegetal no ácido K+. Los silicatos de capa presentes en suelos intermedios aún pueden mantener cationes en sus superficies cargadas negativamente que pueden liberarse cuando las plantas los necesiten. Estos suelos se encuentran en los aún fértiles cinturones de maíz y trigo.
Sustitución isomórfica
Los iones de polisilicato tienen cargas negativas que deben compensarse con cationes apropiados. Los oxígenos terminales poseen superficies cargadas negativamente que se aproximan a superficies compactas de carga negativa. Los cationes que se necesitan para neutralizar la carga negativa del polisilicato se encuentran en las capas entre las cadenas o capas o en los orificios tetraédricos u octaédricos presentes en la red 3D.
Los tipos de cationes encontrados en una forma particular de polisilicato dependerán de»
- el tamaño de los cationes
- la carga de los cationes
Dado que existen bastantes conjuntos de iones que tienen la misma carga y radios muy similares, hay pocas razones para que uno de estos tipos de iones coincidentes se prefiera sobre otro cuando se forma un mineral al enfriarse el magma fundido.
Por ejemplo, el olivino, que tiene una composición ideal de Mg2SiO4, puede contener porcentajes variables de substitución isomórfica de Fe2+ (radio 92 pm) en lugar de un número igual de iones Mg2+ (radio 86 pm).
Primer Principio de Substitución isomórfica
Segundo principio de Sustitución isomórfica
La sustitución isomórfica aumenta el número de sustituciones posibles en silicatos.
Ejemplos
- K+se puede reemplazar por los raros iones Rb+ y Tl+, así como el común Ba2+
- Ca2+se puede reemplazar por Sr2+(132 pm), Na+(116 pm), Y3+(104 pm), La3+ (117 pm) y los iones de bloque f del sexto período (100-117 pm)
- Si4+ se puede reemplazar por el ion común Al3+ (67 pm)
Los cationes en la mayoría de los minerales de silicato se sustituyen ampliamente, lo que hace minerales no económicos para la mayoría de los elementos. Hay relaciones diagonales de elementos (especialmente en el segundo período) con los elementos un grupo a la derecha y un período abajo en la mesa.
 ¿Cuál de los siguientes minerales podría surgir por procesos de sustitución isomórfica en leucita, K(AlSi2O6)?
¿Cuál de los siguientes minerales podría surgir por procesos de sustitución isomórfica en leucita, K(AlSi2O6)?
- K(YSi2O6)
- Rb(AlSi2O6)
- Ba(BeSi2O6)
- Ba(AlSi2O6)
SUGERENCIA: Hay dos principios fundamentales de los compuestos iónicos que deben ser observadas en la sustitución isomorfa:
- La carga total de todos los cationes debe ser igual a la carga total de todos los aniones.
- Para que la sustitución sea isomorfa, el número total de cationes que entran debe ser aproximadamente igual a la carga total de todos los cationes que se sustituyen.