Akkumulierende Hinweise deuten darauf hin, dass Störungen der Phosphorylierungs- / Dephosphorylierungssignalisierung mit pathologischem Verhalten von Zellen assoziiert sind. Phospho-Proteom-Projekte haben fast 300.000 phosphorylierte Ser / Thr / Tyr-Reste in zellulären Proteinen identifiziert . Parallel dazu deckte das Humangenomprojekt etwa 500 Proteinkinasen auf. Dennoch wurde jeder Phosphorylierungsstelle eine begrenzte Anzahl von Proteinkinasen zugeordnet.
Der In-Gel-Phosphorylierungstest war eine praktische Methode zum Nachweis von Proteinkinaseaktivitäten in mit SDS solubilisierten Proben. Diese Methode wurde zur Identifizierung von CaMKII, MYPT1-K (oder ZIPK) und anderen angewendet . In diesem Testprotokoll werden Proteinkinasen auf ein SDS-Polyacrylamidgel geladen, das mit einem Substratpolypeptid eingebettet ist, und dann einer Renaturierung, Phosphorylierung unter Verwendung von radioaktivem ATP, gefolgt von einer Autoradiographie zum Nachweis eines phosphorylierten Substrats unterzogen. Darüber hinaus wurde die Autophosphorylierung von Kinasen auf Nitrozellulose- oder Polyvinylidenfluorid (PVDF) -Membranen unter Verwendung von radioaktivem ATP nachgewiesen . Das radioaktive Material kann aufgrund von Sicherheitsvorschriften eine Einschränkung für die Benutzer darstellen. Darüber hinaus fehlen Autoradiogrammen phosphorylierter Proteine Informationen über Phosphorylierungsstellen.
Hier haben wir einen nichtradioaktiven alternativen Assay zum traditionellen In-Gel-Phosphorylierungs-Assay optimiert. Mit dem Namen Kinase Activity-tagged Western Blotting (KAT-WB) werden Tyr-Kinasen, die sich selbst autophosphorylieren, sowie Ser / Thr-Kinasen, die ein interessierendes Substratprotein an einer bestimmten Stelle phosphorylieren, erfolgreich mit phospho (P) -spezifischen Antikörpern nachgewiesen.
Abbildung 1 zeigt KAT-WB-Daten für den Tyr-Kinase-Autophosphorylierungstest. Um doppelte Blots herzustellen, wurden zwei Aliquots eines Extrakts auf ein SDS-Polyacrylamidgel geladen, einer Elektrophorese unterzogen und dann Proteine auf eine PVDF-Membran (0,2 µm) übertragen. Die Membran wurde sequentiell mit gepuffertem 2-Propanol, 6,0 M Guanidinhydrochlorid (Gu-HCl), 3,0 M Gu-HCl, 0,1 M Gu-HCl und Renaturierungspuffer behandelt (siehe Zusatzprotokoll). Nach einem Renaturierungsschritt über Nacht bei 4 ° C wurde die Membran der Länge nach geschnitten, um zwei doppelte Stücke zu erzeugen (Abbildung 1). Ein Stück Membran wurde 60 min mit 1 mM MgATP inkubiert. Das andere Membranstück wurde ohne MgATP als Kontrolle inkubiert. Beide Blätter wurden gleichzeitig einer Immundetektion mit Anti-P-Tyr-Antikörper (Klon PY20 bei 1:5000 Verdünnung) unterzogen. Wie in Abbildung 1 gezeigt, wurden mehrere P-Tyr-Banden bei 100, 70, 45 und 35 kDa in der Kontrollmembran (oben links) nachgewiesen. Diese P-Tyr-Proteine waren vermutlich bereits vor der Extraktion phosphoryliert. Die Inkubation mit MgATP nach der Trennung erhöhte die Tyr-Phosphorylierung eines Proteins bei 45 kDa in Herzmuskellysaten (Abbildung 1, oben rechts, Spur 2), was auf eine Autophosphorylierung von Tyr-Resten in dieser Kinase auf der Membran nach der Renaturierung hinweist. Abbildung 1 zeigt Densitogramme von Spur 2 (-/+ MgATP). Um die äquivalente Beladung der beiden Blots mit Protein zu verifizieren, wurden die Filter einer Coomassie-Färbung unterzogen (Abbildung 1, unten). Ein technischer Hinweis ist, dass wir im Laufe der Entwicklung der Methode festgestellt haben, dass die Behandlungen mit gepuffertem 2-Propanol und 6M Gu-HCl beide für den Nachweis von Kinaseaktivitäten notwendig waren. Daher detektierte KAT-WB eine 45-kDa-Tyr-Kinase.

Gesamtproteine des Skelettmuskels der Maus (31 µg), des Herzmuskels (28 µg) und der Neuro2a-Zellen (27 µg) wurden einem KAT-Western-Blotting unterzogen. Nach der Renaturierung wurde die Membran längs in zwei Teile geschnitten und jedes Teil 60 min bei 37 °C in Abwesenheit (links) oder Anwesenheit (rechts) von 1 mM ATP inkubiert. Die Tyr-Phosphorylierung wurde durch eine konventionelle Elektrochemilumineszenzmethode unter Verwendung eines Anti-P-Tyr-Antikörpers (top) nachgewiesen. Nach dem Immunoblotting wurden die Gesamtproteine auf jedem Blot durch Coomassie-Färbung sichtbar gemacht (unten). Zahlen auf der rechten Seite zeigen Molekulargewichte von Markerproteinen (in kDa). Ein Feld rechts zeigt Densitogramme der Spur 2 im linken und rechten Bereich an. Helligkeits- und Kontraststufen von Flecken sind identisch.
Eine andere Version von KAT-WB verwendet eine ortsspezifische Phosphorylierung eines Substratproteins, das auf der PVDF-Membran in der Nähe der Kinase absorbiert wird. Wir verwendeten Phosphatase-Holoenzym-Inhibitor-1 (PHI-1) als Protein von Interesse, dessen Phosphorylierung bei Thr57 dieses zelluläre Protein in einen Inhibitor der Typ-1-Ser / Thr-Phosphatase umwandelt . Abbildung 2A zeigt KAT-WB-Daten unter Verwendung von rekombinantem ZIPK als Positivkontrolle, einer Ser / Thr-Kinase, von der bekannt ist, dass sie rekombinantes PHI-1 bei Thr57 phosphoryliert. Nach der Denaturierung und dem stufenweisen Renaturierungsprozess wurde die Membran über Nacht bei 4°C in dem mit rekombinantem PHI-1 Wildtyp (WT) oder einer nichtphosphorylierbaren Version (T57H) ergänzten Renaturierungspuffer bei 0,2 mg/ml getränkt und anschließend die Phosphorylierungsreaktion mit MgATP durchgeführt. Phosphoryliertes PHI-1 auf der Membran wurde unter Verwendung des Antikörpers anti-P-PHI-1 (Thr57) nachgewiesen, und dieser zeigte eine Bande des rekombinanten ZIPK. Auf den Kontrollmembranen ohne PHI-1 oder mit der T57H-Version von PHI-1 wurde jedoch nur ein schwaches Signal festgestellt. Diese Daten legen nahe, dass renaturierte Kinasen auf der Membran Substrate phosphorylieren können, die ebenfalls von der Membran absorbiert werden. KAT-WB wurde angewendet, um mehrere PHI-1-Kinasen in Geweben und Zellen nachzuweisen (Abbildung 2B). Extrakte aus Skelett-, Herzmuskel- und Neuro2a-Zellen von Ratten wurden einem KAT-WB-Assay unterzogen. Im Vergleich zur No-ATP-Kontrolle (links, oben) traten auf dem mit 1 mM MgATP inkubierten Blot Signale von P-PHI-1 auf (rechts, oben). Prominente Banden von P-PHI-1 wurden in Neuro2a-Zelllysaten bei 100, 60 und 49 kDa nachgewiesen (Spur 3, offene Pfeilspitze). In der Spur mit den Extrakten der Skelett- und Herzmuskulatur (Spuren 1 und 2) waren jedoch keine Banden für P-PHI-1 erkennbar. Das P-PHI-1-Signal wurde durch den Phosphorylierungsschritt ohne PHI-1 nicht verstärkt (Abbildung 2, unten, Leerzeichen: BLK). Diese Ergebnisse zeigen, dass es mehrere PHI-1-Kinasen gibt, die in neuronalen Zellen exprimiert werden, jedoch nicht in Skelett- oder Herzmuskeln. Dies bietet uns ein leistungsfähiges Werkzeug zum Nachweis mehrerer substratspezifischer Kinasen in Zellen und Geweben. Ein technischer Hinweis ist, dass die nächtliche Renaturierung mit PHI-1 für den Nachweis der Phosphorylierungssignale notwendig war und dass eine höhere Konzentration von PHI-1 die Färbungsintensität nicht erhöhte (nicht gezeigt).
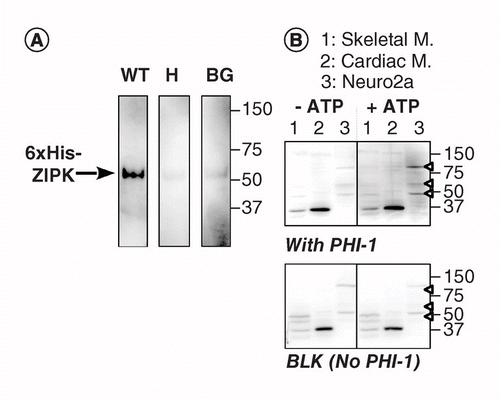
(A) Triplikat-Blots wurden unter Verwendung von rekombinantem ZIPK hergestellt, das teilweise aus Lysaten von Zellen gereinigt wurde, die eine 6× His-markierte Version exprimierten. Nach dem Elektroblotting und dem Denaturierungs–Renaturierungsprozess wurde die Membran über Nacht mit rekombinanten PHI-1-Proteinen (WT: links; T57H: Mitte) bei 0,2 mg/ml oder ohne PHI-1 (BG) inkubiert. Jede Membran wurde dann mit 1 mM ATP bei 37 °C inkubiert und einer Immundetektion unter Verwendung eines Anti-P-PHI-1 (T57) -Antikörpers unterzogen. (B) Zwei doppelte Blots (oben und unten) wurden unter Verwendung von Gesamtproteinproben hergestellt, wie in Abbildung 1 beschrieben. Rekombinantes PHI-1 (0,2 mg/ml) wurde dem Renaturierungspuffer für einen Blot (oben) zugesetzt. BLK gibt den Blot ohne die rekombinante PHI-1-Behandlung an. Nach Inkubation in Abwesenheit (links) und Anwesenheit (rechts) von 1 mM ATP wurden die Blots einer Immundetektion mit anti-P-PHI-1 (Thr57) unterzogen. Pfeilspitzen rechts zeigen die Positionen von P-PHI-1 im oberen rechten Bereich an. Helligkeits- und Kontraststufen von Flecken sind identisch.
BG: Hintergrund; WT: Wildtyp.
Basierend auf diesen Daten schlagen wir vor, dass KAT-WB in der Lage ist, die Autophosphorylierung von Tyr-Kinasen und die ortsspezifische Phosphorylierung von selektiven Substratproteinen von Interesse durch mehrere in Geweben und Zellen vorhandene Proteinkinasen nachzuweisen. KAT-WB teilt im Wesentlichen die Vorteile des traditionellen In-Gel-Phosphorylierungstests, der Kinaseaktivitäten in einer Rohmischung wie Zellextrakten nachweist und deren Molekülgrößen freilegt . Ein weiterer Vorteil dieser beiden Assays besteht darin, dass posttranslationale Modifikationen (PTMs) von Kinasen in Zellen zu einem gewünschten Zeitpunkt unter bestimmten Bedingungen konserviert werden können, da die Proben für diese Assays schnell mit dem Puffer, einschließlich SDS, denaturiert werden, wodurch Phosphorylierung und Dephosphorylierung in den Extrakten eliminiert werden . Die meisten Proteinkinasen werden durch PTM reguliert. KAT-WB ist in der Lage, Schwankungen der Kinaseaktivitäten zu überwachen, auch wenn regulatorische PTMs noch nicht charakterisiert sind. KAT-WB ist nicht in der Lage, jede Kinase in Zellextrakten nachzuweisen, da nur monomere Enzyme, die unter den verwendeten Bedingungen effektiv renaturieren, Aktivität zeigen. Modifikationen von KAT-WB sollten jedoch in der Lage sein, Kinasen nachzuweisen, die durch Calmodulin und Cycline reguliert werden, wie dies durch In-Gel-Phosphorylierungstests geschehen ist . Die Verbesserung der Renaturierungseffizienz und eine Kombination mit Immunpräzipitation / Immundepletion mit Antikörpern für Kinasen können den Nutzen des Ansatzes erweitern.
Es ist bemerkenswert, dass zusätzlich zur Phosphorylierung das Prinzip des KAT-WB-Protokolls für den Nachweis anderer PTM-Enzyme, wie Acetylasen, Methylasen und Ubiquitinligasen, angewendet werden kann, wenn PTM-spezifische Antikörper verfügbar sind. Zusammen mit der Entwicklung von Antikörpern, die ortsspezifische PTMs erkennen, werden Forschungsziele, die durch aktivitätsmarkiertes Western Blotting abgedeckt werden, erweitert.
Autorenbeiträge
M Eto, S Katsuki, Y Tanaka und K Takeya konzipierten und entwarfen die Experimente. S Katsuki, Y Tanaka und K Takeya führten die Assays durch. M Eto, S Katsuki, Y Tanaka und K Takeya führten die Datenanalyse durch. M Eto, S Katsuki, Y Tanaka und K Takeya schrieben das Papier.
Danksagung
Die Autoren danken DL Brautigan für das Korrekturlesen des Manuskripts und für wertvolle Anregungen.
Finanziell & Offenlegung konkurrierender Interessen
Diese Arbeit wird von JSPS KAKENHI (JP19K06573 und JP19H03125) und der Society for Research on Umami Taste, Mitteln der Stadt Imabari und der Präfektur Ehime sowie einem Geschenk von H Awagi unterstützt. Die Autoren haben keine andere relevante Zugehörigkeit oder finanzielle Beteiligung an einer Organisation oder Entität mit einem finanziellen Interesse an oder finanziellen Konflikten mit dem Gegenstand oder den Materialien, die im Manuskript diskutiert werden, abgesehen von den offengelegten.
Bei der Herstellung dieses Manuskripts wurde keine Schreibhilfe in Anspruch genommen.
Open access
Dieses Werk ist lizenziert unter der Namensnennung-Nicht-kommerziell-keine Bearbeitung 4.0 Unported License. Um eine Kopie dieser Lizenz anzuzeigen, besuchen Sie http://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. Hornbeck PV, Zhang B, Murray B et al. PhosphoSitePlus, 2014: Mutationen, PTMs und Rekalibrierungen. Nukleinsäuren Res. 43, D512-D520 (2015).Crossref, Medline, CAS, Google Scholar
- 2. Celenza JL, Carlson M. Renaturierung der Proteinkinaseaktivität auf Proteinflecken. Methoden Enzymol. Academic Press, Cambridge Massachusetts, 34, 423-430 (1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. Renaturierung der calcium/Calmodulin-abhängigen Proteinkinase-Aktivität nach elektrophoretischer Übertragung von Natriumdodecylsulfat-Polyacrylamid-Gelen auf Membranen. Anal. Biochem. 211(1), 131–138 (1993).Crossref, Medline, CAS, Google Scholar
- 6. Macdonald JA, Borman MA, Muranyi A et al. Identifizierung der endogenen Myosin-Phosphatase-assoziierten Kinase der glatten Muskulatur. Prok. In: Natl Acad. Sci. USA 98(5), 2419-2424 (2001).Crossref, Medline, CAS, Google Scholar
- 7. Wooten MW. In-Gel-Kinase-Assay als Methode zur Identifizierung von Kinasesubstraten. Sci. STKE 2002(153), pl15 (2002).Medline, Google Scholar
- 8. Celenza J, Carlson M. Ein Hefegen, das für die Freisetzung aus Glucose-Repression essentiell ist, kodiert eine Proteinkinase. Wissenschaft 233(4769), 1175-1180 (1986).Crossref, Medline, CAS, Google Scholar
- 9. Eto M, Karginov A, Brautigan DL. Ein neuartiger Phosphoprotein-Inhibitor von Protein-Typ-1-Phosphatase-Holoenzymen. Biochemie 38(51), 16952-16957 (1999).Crossref, Medline, CAS, Google Scholar
- 10. Macdonald JA, Eto M, Borman MA et al. Duale Ser- und Thr-Phosphorylierung von CPI-17, einem Inhibitor der Myosinphosphatase, durch MYPT-assoziierte Kinase. FEBS Lett. 493(2–3), 91–94 (2001).Crossref, Medline, CAS, Google Scholar
- 11. Eto M, Leach C, Tountas NA et al. Phosphoprotein-Inhibitoren der Proteinphosphatase-1. Methoden Enzymol. 366, 243–260 (2003).Medline, CAS, Google Scholar
- 12. Rousell J, Haddad El B, Lindsay MA et al. Regulation der m2-Muskarinrezeptor-Genexpression durch Thrombozyten-abgeleiteten Wachstumsfaktor: Beteiligung extrazellulärer signalregulierter Proteinkinasen am Down-Regulationsprozess. Mol. Pharmacol. 52(6), 966–973 (1997).Crossref, Medline, CAS, Google Scholar