L’accumulation de preuves suggère que des perturbations de la signalisation de phosphorylation / déphosphorylation sont associées à des comportements pathologiques des cellules. Les projets de phospho-protéome ont identifié près de 300 000 résidus Ser/Thr/Tyr phosphorylés dans les protéines cellulaires. En parallèle, le projet sur le génome humain a mis au jour environ 500 protéines kinases. Pourtant, un nombre limité de protéines kinases ont été affectées à chaque site de phosphorylation.
Le test de phosphorylation dans le gel a été une méthode pratique pour détecter les activités des protéines kinases dans des échantillons solubilisés avec des FDS. Cette méthode a été appliquée pour l’identification de CaMKII, MYPT1-K (ou ZIPK) et autres. Dans ce protocole de dosage, les protéines kinases sont chargées sur un gel de polyacrylamide SDS noyé dans un polypeptide de substrat, puis soumises à une renaturation, une phosphorylation à l’aide d’ATP radioactif, suivie d’une autoradiographie pour détecter le substrat phosphorylé. De plus, une autophosphorylation des kinases a été détectée sur membrane de nitrocellulose ou de fluorure de polyvinylidène (PVDF) à l’aide d’ATP radioactif. Les matières radioactives peuvent être une limitation pour les utilisateurs, en raison des règles de sécurité. De plus, les autoradiogrammes de protéines phosphorylées ne contiennent aucune information sur les sites de phosphorylation.
Ici, nous avons optimisé un test alternatif non radioactif au test traditionnel de phosphorylation sur gel. Nommé western blot marqué par l’activité kinase (KAT-WB), il détecte avec succès les Tyr-kinases qui s’autophosphorylent elles-mêmes ainsi que les Ser/Thr-kinases qui phosphorylent une protéine de substrat d’intérêt sur un site spécifique à l’aide d’anticorps spécifiques phospho(P).
La figure 1 montre les données KAT-WB pour le test d’autophosphorylation de la Tyr-kinase. Pour réaliser des taches en double, deux aliquotes d’un extrait ont été chargées sur un gel de polyacrylamide SDS, soumises à une électrophorèse, puis des protéines ont été transférées sur une feuille de membrane PVDF (0,2 µm). La membrane a été traitée séquentiellement avec du 2-propanol tamponné, du chlorhydrate de guanidine 6,0 M (Gu-HCl), du Gu-HCl 3,0 M, du Gu-HCl 0,1 M et du tampon de renaturation (voir Protocole additionnel). Après une étape de renaturation nocturne à 4°C, la membrane a été coupée dans le sens de la longueur pour générer deux pièces en double (Figure 1). Une pièce de membrane a été incubée pendant 60 min avec 1 mm MgATP. L’autre morceau de membrane a été incubé sans MgATP, comme témoin. Les deux feuilles ont été soumises simultanément à une immunodétection avec l’anticorps anti-P-Tyr (Clone PY20 à dilution 1:5000). Comme le montre la figure 1, plusieurs bandes P-Tyr ont été détectées à 100, 70, 45 et 35 kDa dans la membrane témoin (en haut à gauche). Ces protéines P-Tyr étaient vraisemblablement déjà phosphorylées avant extraction. L’incubation avec MgATP après séparation a augmenté la phosphorylation Tyr d’une protéine à 45 kDa dans les lysats du muscle cardiaque (Figure 1, en haut à droite, voie 2), indiquant une autophosphorylation des résidus Tyr dans cette kinase sur la membrane après renaturation. La figure 1 montre les densitogrammes de la voie 2 (-/+ MgATP). Pour vérifier une charge équivalente de protéines sur les deux blots, les filtres ont été soumis à une coloration de Coomassie (Figure 1, en bas). Une note technique est qu’au cours du développement de la méthode, nous avons constaté que les traitements avec du 2-propanol tamponné et du Gu-HCl 6M étaient tous deux nécessaires à la détection des activités kinases. Par conséquent, KAT-WB a détecté une Tyr kinase de 45 kDa.

Les protéines totales du muscle squelettique de souris (31 µg), du muscle cardiaque (28 µg) et des cellules Neuro2a (27 µg) ont été soumises à un transfert KAT-western. Après renaturation, la membrane a été coupée en deux dans le sens de la longueur, et chaque partie a été incubée pendant 60 min à 37°C en l’absence (à gauche) ou en présence (à droite) de 1 mm d’ATP. La Tyr-phosphorylation a été détectée par une méthode électrochimiluminescente classique utilisant l’anticorps Anti-P-Tyr (top). Après l’immunoblot, les protéines totales sur chaque tache ont été visualisées par coloration de Coomassie (en bas). Les nombres à droite indiquent les poids moléculaires des protéines marqueurs (en kDa). Une case à droite indique les densitogrammes de la voie 2 dans les panneaux de gauche et de droite. Les niveaux de luminosité et de contraste des taches sont identiques.
Une autre version de KAT-WB utilise la phosphorylation spécifique au site d’une protéine de substrat absorbée sur la membrane PVDF à proximité de la kinase. Nous avons utilisé l’inhibiteur de l’holoenzyme de la phosphatase-1 (PHI-1) comme protéine d’intérêt, dont la phosphorylation à Thr57 convertit cette protéine cellulaire en un inhibiteur de la phosphatase Ser/ Thr de type 1. La figure 2A montre les données de KAT-WB utilisant comme témoin positif le ZIPK recombinant, une kinase Ser/Thr connue pour phosphoryler le PHI-1 recombinant à Thr57. Après la dénaturation et le processus de renaturation par étapes, la membrane a été trempée pendant une nuit à 4 ° C dans le tampon de renaturation additionné de type sauvage recombinant PHI-1 (WT) ou d’une version non phosphorylable (T57H) à 0,2 mg/ml, puis la réaction de phosphorylation a été conduite avec MgATP. Le PHI-1 phosphorylé sur la membrane a été détecté à l’aide de l’anticorps anti-P-PHI-1 (Thr57), ce qui a révélé une bande du ZIPK recombinant. Cependant, seul un signal faible a été détecté sur les membranes de contrôle sans PHI-1 ou avec la version T57H de PHI-1. Ces données suggèrent que les kinases renaturées sur la membrane sont capables de phosphoryler des substrats qui sont également absorbés sur la membrane. KAT-WB a été appliqué pour détecter de multiples kinases PHI-1 dans les tissus et les cellules (figure 2B). Des extraits de squelettes de rat, de muscles cardiaques et de cellules Neuro2a ont été soumis à un test KAT-WB. Par rapport au contrôle no-ATP (à gauche, en haut), des signaux de P-PHI-1 sont apparus sur le blot incubé avec 1 mm MgATP (à droite, en haut). Des bandes proéminentes de P-PHI-1 ont été détectées dans des lysats de cellules Neuro2a à 100, 60 et 49 kDa (voie 3, pointe de flèche ouverte). Cependant, aucune bande pour P-PHI-1 n’était évidente dans la voie avec les extraits de muscles squelettiques et cardiaques (voies 1 et 2). Le signal P-PHI-1 n’a pas été amélioré par l’étape de phosphorylation sans PHI-1 (Figure 2, bas, blanc : BLK). Ces résultats montrent qu’il existe plusieurs kinases PHI-1 exprimées dans les cellules neuronales mais pas dans les muscles squelettiques ou cardiaques. Cela nous fournit un outil puissant pour détecter de multiples kinases spécifiques au substrat dans les cellules et les tissus. Une note technique est que la renaturation nocturne avec PHI-1 était nécessaire pour la détection des signaux de phosphorylation, et qu’une concentration plus élevée de PHI-1 n’augmentait pas l’intensité de coloration (non représentée).
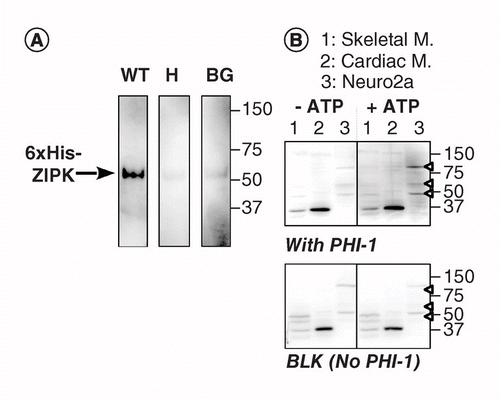
(A) Des blots triplicatés ont été préparés en utilisant du ZIPK recombinant partiellement purifié à partir de lysats de cellules exprimant une version marquée 6× His. Après électroblotage et processus de dénaturation-renaturation, la membrane a été incubée pendant une nuit avec des protéines PHI-1 recombinantes (POIDS : gauche; T57H : centre) à 0,2 mg/ml ou sans PHI-1 (BG). Chaque membrane a ensuite été incubée avec 1 mm d’ATP à 37°C et soumise à une immunodétection à l’aide de l’anticorps anti-P-PHI-1 (T57). (B) Deux blots dupliqués (en haut et en bas) ont été préparés à l’aide d’échantillons de protéines totales, comme décrit à la figure 1. Du PHI-1 recombinant (0,2 mg/ml) a été ajouté au tampon de renaturation pour une tache (top). BLK indique le blot sans traitement PHI-1 recombinant. Après incubation en l’absence (à gauche) et en présence (à droite) d’ATP 1 mM, les blots ont été soumis à une immunodétection par anti-P-PHI-1 (Thr57). Les pointes de flèches à droite indiquent les emplacements de P-PHI-1 dans le panneau supérieur droit. Les niveaux de luminosité et de contraste des taches sont identiques.
BG: Arrière-plan; POIDS: Type sauvage.
Sur la base de ces données, nous proposons que KAT-WB est capable de détecter l’autophosphorylation des Tyr kinases et la phosphorylation spécifique au site de protéines de substrat sélectives d’intérêt par de multiples protéines kinases présentes dans les tissus et les cellules. KAT-WB partage essentiellement les avantages du test de phosphorylation traditionnel sur gel, qui détecte les activités kinases dans un mélange brut, comme les extraits de cellules, en exposant leurs tailles moléculaires. Un autre avantage de ces deux dosages est que les modifications post-traductionnelles (PTMS) des kinases dans les cellules peuvent être conservées à un moment désiré dans des conditions spécifiques, car les échantillons pour ces dosages sont rapidement dénaturés avec le tampon, y compris le SDS, éliminant la phosphorylation et la déphosphorylation dans les extraits. La plupart des protéines kinases sont régulées par PTM. KAT-WB est capable de surveiller les fluctuations des activités de la kinase, même si les PTM réglementaires n’ont pas encore été caractérisés. KAT-WB est incapable de détecter toutes les kinases dans les extraits cellulaires car seules les enzymes monomères qui renaturent efficacement dans les conditions utilisées montrent une activité. Cependant, les modifications de KAT-WB devraient pouvoir détecter des kinases régulées par la calmoduline et les cyclines, comme cela a été fait par un test de phosphorylation sur gel. L’amélioration de l’efficacité de la renaturation et une combinaison avec l’immunoprécipitation / immunodéplétion avec des anticorps pour les kinases peuvent étendre l’utilité de l’approche.
Il est à noter qu’en plus de la phosphorylation, le principe du protocole KAT-WB peut être appliqué pour la détection d’autres enzymes PTM, telles que les acétylases, les méthylases et les ligases d’ubiquitine, lorsque des anticorps spécifiques au PTM sont disponibles. Parallèlement au développement d’anticorps qui reconnaissent les PTM spécifiques au site, les cibles de recherche couvertes par le western blot marqué par une activité seront élargies.
Contributions des auteurs
M Eto, S Katsuki, Y Tanaka et K Takeya ont conçu et conçu les expériences. S Katsuki, Y Tanaka et K Takeya ont effectué les tests. M Eto, S Katsuki, Y Tanaka et K Takeya ont effectué l’analyse des données. M Eto, S Katsuki, Y Tanaka et K Takeya ont écrit le journal.
Remerciements
Les auteurs tiennent à remercier DL Brautigan pour la relecture du manuscrit et pour ses précieuses suggestions.
Informations financières & divulgation d’intérêts concurrents
Ce travail est soutenu par JSPS KAKENHI (JP19K06573 et JP19H03125) et la Society for Research on Umami Taste, des fonds de la ville d’Imabari et de la préfecture d’Ehime, et un don de H Awagi. Les auteurs n’ont aucune autre affiliation ou implication financière pertinente avec une organisation ou une entité ayant un intérêt financier ou un conflit financier avec le sujet ou les documents discutés dans le manuscrit en dehors de ceux divulgués.
Aucune aide à l’écriture n’a été utilisée pour la production de ce manuscrit.
Open access
Ce travail est sous licence Attribution-NonCommercial-NoDerivatives 4.0 Unported License. Pour consulter une copie de cette licence, visitez http://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. C.P. Hornbeck, Zhang B., Murray B. et coll. PhosphoSitePlus, 2014 : mutations, PTMs et recalibrations. Acides nucléiques Res. 43, D512-D520 (2015).Crossref, Medline, CAS, Google Scholar
- 2. Celenza JL, Carlson M. Renaturation de l’activité de la protéine kinase sur les taches de protéines. Méthodes Enzymol. Academic Press, Cambridge Massachusetts, 34, 423-430 (1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. Renaturation de l’activité de la protéine kinase dépendante du calcium / calmoduline après transfert électrophorétique des gels de dodécylsulfate de sodium-polyacrylamide aux membranes. Anal. Biochem. 211(1), 131–138 (1993).Crossref, Medline, CAS, Google Scholar
- 6. Il s’agit de l’un des plus grands groupes de la planète. Identification de la kinase associée à la myosine phosphatase du muscle lisse endogène. Proc. Natl Acad. Sci. États-Unis 98(5), 2419-2424 (2001).Crossref, Medline, CAS, Google Scholar
- 7. Wooten MW. Analyse de kinase en gel comme méthode pour identifier les substrats de kinase. Sci. STKE 2002 (153), pl15 (2002).Medline, Google Scholar
- 8. Celenza J, Carlson M. Un gène de levure essentiel à la libération de la répression du glucose code pour une protéine kinase. Sciences 233(4769), 1175-1180 (1986).Crossref, Medline, CAS, Google Scholar
- 9. Eto M, Karginov A, Brautigan DL. Un nouvel inhibiteur de phosphoprotéines des holoenzymes de phosphatase de type 1 de protéine. Biochimie 38(51), 16952-16957 (1999).Crossref, Medline, CAS, Google Scholar
- 10. Macdonald JA, Eto M, Borman MA et coll. Phosphorylation double Ser et Thr de CPI-17, un inhibiteur de la myosine phosphatase, par la kinase associée à la MYPT. FEBS Lett. 493(2–3), 91–94 (2001).Crossref, Medline, CAS, Google Scholar
- 11. Eto M, Lixiviation C, Tountas NA et al. Inhibiteurs de phosphoprotéines de la protéine phosphatase-1. Méthodes Enzymol. 366, 243–260 (2003).Medline, CAS, Google Scholar
- 12. Rousell J, Haddad El B, Lindsay MA et coll. Regulation of m2 muscarinic receptor gene expression by plaquette-derived growth factor: involvement of extracellular signal-regulated protein kinases in the down-regulation process. Mol. Pharmacol. 52(6), 966–973 (1997).Crossref, Medline, CAS, Google Scholar