a felhalmozódó bizonyítékok arra utalnak, hogy a foszforiláció/defoszforiláció jelátvitel zavarai a sejtek kóros viselkedésével járnak. A foszfo-proteom projektek közel 300 000 foszforilált Ser/Thr/Tyr maradékot azonosítottak a sejtfehérjékben . Ezzel párhuzamosan az emberi genom projekt körülbelül 500 protein-kinázt fedezett fel. Mégis, korlátozott számú protein-kinázt rendeltek az egyes foszforilációs helyekhez.
a gélen belüli foszforilációs vizsgálat kényelmes módszer volt a protein-kináz aktivitás kimutatására az SDS-sel oldott mintákban. Ezt a módszert alkalmazták a CaMKII, MYPT1-K (vagy ZIPK) és mások azonosítására . Ebben a vizsgálati protokollban a protein-kinázokat egy szubsztrát polipeptidbe ágyazott SDS-poliakrilamid gélre töltik, majd renaturációnak, radioaktív ATP alkalmazásával foszforilezésnek vetik alá, majd autoradiográfiával detektálják a foszforilezett szubsztrátot. Ezenkívül a kinázok autofoszforilezését kimutatták nitrocellulóz vagy polivinilidén-fluorid (PVDF) membrán radioaktív ATP alkalmazásával . A radioaktív anyag a biztonsági előírások miatt korlátozást jelenthet a felhasználók számára. Ezenkívül a foszforilezett fehérjék autoradiogramjaiból hiányzik a foszforilációs helyekről szóló információ.
itt nem radioaktív alternatív vizsgálatot optimalizáltunk a hagyományos gélen belüli foszforilációs vizsgálathoz. Nevezett kináz aktivitással jelölt western blot (KAT-WB), ez sikeresen detektálja azokat a Tyr-kinázokat, amelyek autofoszforilálják magukat, valamint a Ser/Thr-kinázokat, amelyek foszfo (P)-specifikus antitestek felhasználásával foszforilálnak egy adott helyen érdekes szubsztrátfehérjét.
az 1.ábra a Tyr-kináz autofoszforilezési vizsgálat KAT-WB adatait mutatja. Ahhoz, hogy duplikált blotokat készítsünk, két alikvot kivonatot töltöttünk egy SDS poliakrilamid gélre, elektroforézisnek vetettük alá, majd a fehérjéket egy PVDF membránlapra helyeztük (0,2 MHz). A membránt egymás után pufferelt 2-propanollal, 6,0 M guanidin-hidrokloriddal (Gu-HCl), 3,0 M Gu-HCl-lel, 0,1 M gu-HCl-lel és renaturációs pufferrel kezeltük (lásd a kiegészítő protokollt). Egy éjszakán át tartó renaturációs lépés után 4 6CC-nél a membránt hosszában levágtuk, hogy két duplikált darabot hozzunk létre (1.ábra). Egy darab membránt inkubáltunk 60 percig 1 mM-es MgATP-vel. A másik membrándarabot mgatp nélkül inkubáltuk kontrollként. Mindkét lapot egyidejűleg immundetektálásnak vetettük alá anti-P-Tyr antitesttel (PY20 klón 1:5000 hígítással). Amint az 1. ábrán látható, több P-Tyr sávot detektáltunk 100, 70, 45 és 35 kDa-nál a kontrollmembránon (bal felső sarokban). Ezeket a P-Tyr fehérjéket feltehetően már az extrakció előtt foszforilálták. Az elválasztás után az mgatp-vel történő inkubáció megemelte a fehérje Tyr-foszforilációját 45 kDa-nál a szívizom lizátumaiban (1.ábra, jobb felső rész, 2. sáv), jelezve a Tyr-maradékok autofoszforilációját ebben a kinázban a membránon renaturációt követően. Az 1. ábra a 2. sáv denzitogrammjait mutatja (- /+ MgATP). Annak ellenőrzésére, hogy a fehérje egyenértékű-e a két bloton, a szűrőket Coomassie festésnek vetettük alá (1.ábra, alsó rész). Technikai megjegyzés, hogy a módszer kidolgozása során megállapítottuk, hogy a pufferolt 2-propanollal és 6M Gu-HCl-lel végzett kezelések egyaránt szükségesek voltak a kinázaktivitás kimutatásához. Ezért a KAT-WB 45-kDa Tyr kinázt észlelt.

az egér vázizomzatának (31 6G), a szívizomnak (28 g) és a Neuro2a sejteknek (27 G) összes fehérjéjét kat-western blot vizsgálatnak vetettük alá. Renaturáció után a membránt hosszában kettévágtuk, és mindegyik részt 60 percig inkubáltuk 37cc-on 1 mM-es ATP hiányában (balra) vagy jelenlétében (jobbra). A Tyr-foszforilációt hagyományos elektrokemilumineszcens módszerrel detektáltuk anti-P-Tyr antitest (top) alkalmazásával. Az immunoblotálás után az egyes blotokon lévő összes fehérjét Coomassie festéssel (alul) vizualizáltuk. A jobb oldali számok a marker fehérjék molekulatömegét jelzik (kDa-ban). A jobb oldali mező a 2. sáv denzitogramjait jelzi a bal és a jobb oldali panelekben. A blotok fényereje és kontrasztja azonos.
A KAT-WB másik változata a PVDF membránon abszorbeált szubsztrát fehérje helyspecifikus foszforilezését használja a kináz közelében. A foszfatáz holoenzim inhibitort-1-et (PHI-1) használtuk érdekes fehérjeként, amelynek foszforilációja a Thr57-nél ezt a sejtfehérjét az 1-es típusú ser/Thr foszfatáz inhibitorává alakítja . A 2A. ábra KAT-WB adatokat mutat be pozitív kontrollként rekombináns zipk, egy ser / Thr kináz felhasználásával, amelyről ismert, hogy a rekombináns PHI-1-et foszforilálja a Thr57-en . A denaturálás és a lépcsőzetes renaturálás után a membránt egy éjszakán át átitatjuk a rekombináns PHI-1 vad típussal (WT) vagy egy nem foszforilálható változattal (T57H) kiegészített renaturációs pufferben, 0,2 mg/ml-en, majd a foszforilációs reakciót MgATP-vel lefuttatjuk. A foszforilált PHI-1-et a membránon anti-P-PHI-1 (Thr57) antitesttel detektáltuk , és ez a rekombináns ZIPK sávját tárta fel. A PHI-1 nélküli vezérlőmembránokon vagy a PHI-1 T57H változatával azonban csak halvány jelet észleltek. Ezek az adatok arra utalnak, hogy a membránon lévő renaturált kinázok képesek foszforilálni azokat a szubsztrátumokat, amelyek szintén felszívódnak a membránra. A KAT-WB – t több PHI-1 kináz kimutatására alkalmazták a szövetekben és a sejtekben (2b.ábra). Patkányváz, szívizmok és Neuro2a sejtek kivonatait KAT-WB vizsgálatnak vetettük alá. A no-ATP kontrollhoz (bal, felső) képest a P-PHI-1 jelei megjelentek az 1 mM-es mgatp-vel inkubált blot-on (jobb, felső). A P-PHI-1 prominens sávjait a Neuro2a sejtlizátumokban 100, 60 és 49 kDa-nál (3.sáv, nyitott nyílhegy) detektálták. Azonban a P-PHI-1 sávjai nem voltak nyilvánvalóak a csontváz és a szívizmok kivonataival (1.és 2. sáv). A P-PHI-1 jelet a PHI-1 nélküli foszforilezési lépés nem javította (2.ábra, alsó, üres: BLK). Ezek az eredmények azt mutatják, hogy több PHI-1 kináz expresszálódik az idegsejtekben, de nem a csontvázban vagy a szívizomban. Ez hatékony eszközt biztosít számunkra több szubsztrát-specifikus kináz kimutatására a sejtekben és szövetekben. Technikai megjegyzés, hogy a foszforilációs jelek kimutatásához szükséges volt a PHI-1 éjszakai renaturálása, és hogy a PHI-1 magasabb koncentrációja nem növelte a festés intenzitását (nem látható).
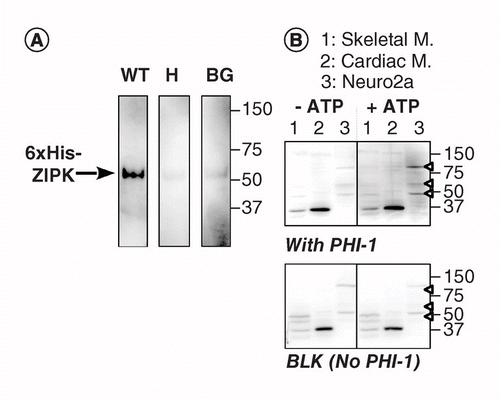
(a) három példányban blotokat állítottunk elő rekombináns zipk-vel, amelyet részben megtisztítottunk a sejtek lizátumaiból, amelyek 6 db-ot expresszálnak. Az elektroblotálás és a denaturációs-renaturációs folyamat után a membránt egy éjszakán át rekombináns PHI-1 fehérjékkel (WT: bal; T57H: center) inkubáltuk 0,2 mg/ml-en vagy PHI-1 (BG) nélkül. Ezután mindegyik membránt 1 mM-es ATP-vel inkubáltuk 37 MHz-en, és anti-P-PHI-1 (T57) antitest alkalmazásával immundetektálásnak vetettük alá. B) két duplikált blotot (felső és alsó) állítottunk elő teljes fehérjeminták felhasználásával, az 1.ábrán leírtak szerint. Rekombináns PHI-1-et (0,2 mg/ml) adtunk a renaturációs pufferhez egy blot (top) céljából. A BLK a rekombináns PHI-1 kezelés nélküli blotot jelzi. 1 mM-es ATP hiányában (balra) és jelenlétében (jobbra) történő inkubálás után a blotokat anti-P-PHI-1 (Thr57) alkalmazásával immundetektálásnak vetettük alá. A jobb oldali nyílhegyek jelzik a P-PHI-1 helyét a jobb felső panelen. A blotok fényereje és kontrasztja azonos.
BG: háttér; WT: vad típusú.
ezen adatok alapján azt javasoljuk, hogy a KAT-WB képes detektálni a Tyr kinázok autofoszforilációját és az érdeklődésre számot tartó szelektív szubsztrát fehérjék helyspecifikus foszforilációját a szövetekben és sejtekben jelen lévő több protein kináz által. A KAT-WB lényegében megosztja a hagyományos gélen belüli foszforilációs vizsgálat előnyeit, amely kinázaktivitást detektál egy nyers keverékben, például sejtkivonatokban, felfedve molekuláris méretüket . E két vizsgálat további előnye, hogy a sejtekben a kinázok poszttranszlációs módosításai (PTMs) a kívánt időpontban, meghatározott körülmények között megőrizhetők, mivel az ezekhez a vizsgálatokhoz használt minták gyorsan denaturálódnak a pufferrel, beleértve az SDS-t is, kiküszöbölve a kivonatokban a foszforilációt és a defoszforilációt . A legtöbb protein-kinázt a PTM szabályozza. A KAT-WB képes monitorozni a kináz aktivitás ingadozásait, még akkor is, ha a szabályozó PTM-eket még nem kell jellemezni. A KAT-WB nem képes kimutatni az összes kinázt a sejtkivonatokban, mert csak azok a monomer enzimek mutatnak aktivitást, amelyek az alkalmazott körülmények között hatékonyan megújulnak. A KAT-WB módosításainak azonban képesnek kell lenniük a kalmodulin és ciklinek által szabályozott kinázok kimutatására, ahogyan azt gélen belüli foszforilációs vizsgálattal tették . A renaturációs hatékonyság javulása és az immunprecipitációval/immunodepletionnal és kináz antitestekkel történő kombináció növelheti a megközelítés hasznosságát.
figyelemre méltó, hogy a foszforilezés mellett A KAT-WB protokoll elve alkalmazható más PTM enzimek, például acetilázok, metilázok és ubiquitin ligázok kimutatására is, ha PTM-specifikus antitestek állnak rendelkezésre. A helyspecifikus PTM-eket felismerő antitestek kifejlesztésével együtt az aktivitással jelölt western blotting által lefedett kutatási célokat kibővítik.
szerzői hozzájárulások
M Eto, s Katsuki, y Tanaka és K Takeya tervezték és tervezték a kísérleteket. S Katsuki, y Tanaka és K Takeya végezte a vizsgálatokat. M Eto, s Katsuki, y Tanaka és K Takeya végezte el az adatok elemzését. M Eto, s Katsuki, y Tanaka és K Takeya írta a dolgozatot.
Köszönetnyilvánítás
a szerzők szeretnék megköszönni DL Brautigannak a kézirat lektorálását és az értékes javaslatokat.
Financial & competiting interests disclosure
ezt a munkát a JSPS KAKENHI (JP19K06573 és JP19H03125) és a Society for Research on Umami Taste, az Imabari city és Ehime prefektúra pénzeszközei, valamint H Awagi ajándéka támogatja. A szerzőknek nincs más releváns kapcsolata vagy pénzügyi részvétele olyan szervezetekkel vagy szervezetekkel, amelyek pénzügyi érdekeltséggel vagy pénzügyi konfliktussal rendelkeznek a kéziratban tárgyalt témával vagy anyagokkal, kivéve a nyilvánosságra hozottakat.
a kézirat elkészítéséhez nem használtak írási segítséget.
nyílt hozzáférés
ez a munka az Attribution-NonCommercial-NoDerivatives 4.0 Unported Licenc alatt van licencelve. A licenc egy példányának megtekintéséhez látogasson el http://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. Hornbeck PV, Zhang B, Murray B és mtsai. PhosphoSitePlus, 2014: mutációk, PTMs és újrakalibrációk. Nukleinsavak Res. 43, D512-D520 (2015).Crossref, Medline, CAS, Google Tudós
- 2. Celenza JL, Carlson M. a protein kináz aktivitás Renaturációja fehérje blotokon. Módszerek Enzimol. Academic Press, Cambridge Massachusetts, 34, 423-430 (1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. A kalcium/kalmodulin-függő protein-kináz aktivitás renaturálása a nátrium-dodecil-szulfát-poliakrilamid gélekből a membránokba történő elektroforetikus transzfer után. Anális. Biochem. 211(1), 131–138 (1993).Crossref, Medline, CAS, Google Tudós
- 6. Macdonald JA, Borman MA, Muranyi a et al. Az endogén simaizom miozin-foszfatáz-asszociált kináz azonosítása. Proc. Natl Acad. Sci. USA 98(5), 2419-2424 (2001).Crossref, Medline, CAS, Google Tudós
- 7. Wooten MW. In-gel kináz vizsgálat mint módszer a kináz szubsztrátok azonosítására. Sci. STKE 2002(153), pl15 (2002).Medline, Google Tudós
- 8. Celenza J, Carlson M. egy élesztőgén, amely elengedhetetlen a glükóz elnyomásából való felszabaduláshoz, protein-kinázt kódol. Tudomány 233(4769), 1175-1180 (1986).Crossref, Medline, CAS, Google Tudós
- 9. Eto M, Karginov A, Brautigan DL. Az 1-es típusú foszfatáz holoenzimek új foszfoprotein inhibitora. Biokémia 38(51), 16952-16957 (1999).Crossref, Medline, CAS, Google Tudós
- 10. Macdonald JA, Eto M, Borman MA et al. A miozin-foszfatáz inhibitora, a CPI-17 kettős ser és Thr foszforilációja a mypt-hez kapcsolódó kináz által. FEBS Lett. 493(2–3), 91–94 (2001).Crossref, Medline, CAS, Google Tudós
- 11. Eto M, Leach C, Tountas NA és mtsai. A fehérje foszfatáz-1 foszfoprotein inhibitorai. Módszerek Enzimol. 366, 243–260 (2003).Medline, CAS, Google Tudós
- 12. Rousell J, Haddad El B, Lindsay MA és mtsai. Az m2 muszkarin receptor gén expressziójának szabályozása vérlemezkéből származó növekedési faktorral: extracelluláris szignál által szabályozott protein-kinázok bevonása a down-regulációs folyamatba. Mol. Pharmacol. 52(6), 966–973 (1997).Crossref, Medline, CAS, Google Tudós