sugere que as perturbações na sinalização da fosforilação/desphosforilação estão associadas a comportamentos patológicos das células. Os projectos fosfo-proteoma identificaram perto de 300 000 resíduos fosforilados de Ser/Thr / Tyr em proteínas celulares . Em paralelo, o Projeto Genoma Humano descobriu aproximadamente 500 cinases proteicas. No entanto, um número limitado de cinases proteicas foram atribuídas a cada local de fosforilação.
o ensaio de fosforilação em gel foi um método conveniente para detectar as actividades da proteína cinase em amostras solubilizadas com SDS. Este método foi aplicado para a identificação de CaMKII, MYPT1-K (ou ZIPK) e outros . Neste protocolo de ensaio, as cinases proteicas são carregadas num gel SDS-poliacrilamida embebido num substrato polipéptido, sendo depois submetidas a renaturação, fosforilação utilizando ATP radioactivo, seguido de autoradiografia para detectar substrato fosforilado. Além disso, foi detectada autofosforilação de cinases na membrana nitrocelulose ou fluoreto de polivinilideno (PVDF) utilizando ATP radioativo . O material radioactivo pode constituir uma limitação para os utilizadores, devido a regulamentos de segurança. Além disso, os autoradiogramas de proteínas fosforiladas carecem de qualquer informação sobre locais de fosforilação.
aqui, optimizámos um doseamento alternativo não radioactivo ao doseamento tradicional de fosforilação em gel. Batizado com atividade cinase western blotting( KAT-WB), isso detecta com sucesso Tyr-kinases que autofosforilato eles mesmos, bem como Ser/Thr-kinases que fosforilato uma proteína substrato de interesse em um local específico usando anticorpos específicos do fósforo (P).
a Figura 1 apresenta dados do KAT-WB para o ensaio de autofosforilação da Tyr-kinase. Para fazer bolhas duplicadas, duas alíquotas de um extracto foram carregadas num gel de poliacrilamida SDS, submetidas a electroforese, e então as proteínas foram transferidas para uma folha de membrana PVDF (0,2 µm). A membrana foi tratada sequencialmente com 2-propanol tamponado, cloridrato de guanidina de 6, 0 M (Gu-HCl), 3, 0 M Gu-HCl, tampão de 0,1 M Gu-HCl e tampão de renaturação (ver Protocolo suplementar). Após uma etapa de renaturação nocturna a 4 ° C, a membrana foi cortada longitudinalmente para gerar duas peças duplicadas (Figura 1). Incubou-se uma peça de membrana durante 60 minutos com 1 mm de pop. A outra parte da membrana foi incubada sem MgATP, como um controle. Ambas as folhas foram simultaneamente submetidas a imunodetecção com anticorpos anti-P-Tyr (Clone PY20 à diluição de 1:5000). Como indicado na Figura 1, foram detectadas múltiplas bandas de P-Tyr a 100, 70, 45 e 35 kDa na membrana de controlo (superior esquerda). Estas proteínas P-Tyr foram presumivelmente já fosforiladas antes da extracção. A incubação com MgATP após a separação elevou a fosforilação Tyr de uma proteína a 45 kDa em lisados musculares cardíacos (Figura 1, canto superior direito, faixa 2), indicando autofosforilação de resíduos de Tyr nesta cinase na membrana após a renaturação. A figura 1 mostra densitogramas da faixa 2 (-/+ MgATP). Para verificar a carga equivalente de proteína nas duas bolhas, os filtros foram submetidos a coloração de Coomassie (Figura 1, fundo). Uma nota técnica é que, no curso do desenvolvimento do método, descobrimos que os tratamentos com 2-propanol tamponado e 6M Gu-HCl eram ambos necessários para a detecção de atividades cinase. Portanto, KAT-WB detectou um Tyr kinase 45-kDa.

outra versão do KAT-WB usa fosforilação específica de um substrato absorvido na membrana PVDF, na proximidade da cinase. Usámos o inibidor da fosfatase holoenzima-1 (PHI-1) como proteína de interesse, cuja fosforilação na Thr57 converte esta proteína celular num inibidor da Ser/Thr fosfatase tipo 1 . A figura 2A mostra os dados de KAT-WB utilizando como controlo positivo o ZIPK recombinante, Uma Ser/Thr kinase conhecida por PHI-1 recombinante do fosforilato em Thr57 . Após a desnaturação e o passo-a-passo renaturation processo, a membrana estava de molho durante a noite a 4°C no renaturation buffer suplementado com recombinante PHI-1 tipo selvagem (WT) ou um nonphosphorylatable versão (T57H) de 0,2 mg/ml e, em seguida, a fosforilação de reação foi executado com MgATP. O PHI-1 fosforilado na membrana foi detectado utilizando o anticorpo anti-P-PHI-1 (Thr57), o que revelou uma banda do ZIPK recombinante. No entanto, apenas um sinal fraco foi detectado nas membranas de controle sem PHI-1 ou com a versão T57H de PHI-1. Estes dados sugerem que as cinases renaturadas na membrana são capazes de fosforilar substratos que também são absorvidos na membrana. O KAT-WB foi aplicado para detectar múltiplas cinases PHI-1 nos tecidos e células (figura 2B). Os extractos do esqueleto de rato, dos músculos cardíacos e das células Neuro2a foram submetidos ao ensaio KAT-WB. Em comparação com o controle no-ATP (esquerdo, superior), sinais de P-PHI-1 apareceram na blot incubada com 1 mM MgATP (direito, superior). Bandas proeminentes de P-PHI-1 foram detectadas em lisatos de células Neuro2a a 100, 60 e 49 kDa (pista 3, open arrowhead). No entanto, nenhuma faixa para P-PHI-1 foi evidente na faixa com os extratos de músculos esqueléticos e cardíacos (faixas 1 e 2). O sinal P-PHI-1 não foi melhorado pelo passo de fosforilação sem PHI – 1 (Figura 2, fundo, em branco: BLK). Estes resultados mostram que existem múltiplas cinases PHI – 1 expressas em células neuronais, mas não em músculos esqueléticos ou cardíacos. Isso nos fornece uma ferramenta poderosa para detectar múltiplas cinases específicas de substrato em células e tecidos. Uma nota técnica é que a renaturação overnight com PHI-1 foi necessária para a detecção dos sinais de fosforilação, e que uma maior concentração de PHI-1 não aumentou a intensidade de coloração (não mostrado).
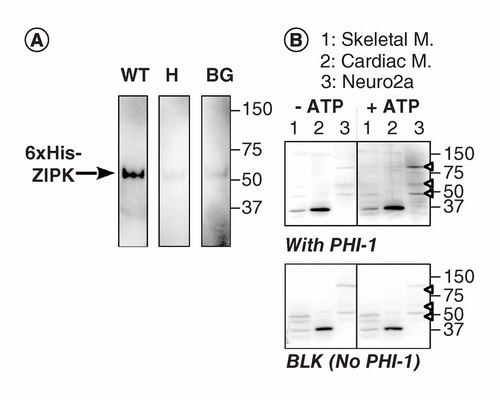
(a) blots triplicados foram preparados utilizando zipk recombinante parcialmente purificado a partir de lisatos de células que expressavam uma versão 6× sua marca. Após o processo de electroblotting e de desnaturação–renaturação, a membrana foi incubada de um dia para o outro com proteínas PHI-1 recombinantes (WT: esquerda; T57H: centro) a 0,2 mg/ml ou sem PHI-1 (BG). Cada membrana foi então incubada com 1 mM de ATP a 37°C e submetida a imunodetecção utilizando anticorpos anti-P-PHI-1 (T57). B) foram preparadas duas borrões duplicadas (superior e inferior) utilizando amostras de proteínas totais, conforme descrito na Figura 1. O PHI-1 recombinante (0, 2 mg/ml) foi adicionado ao tampão de renaturação para uma mancha (topo). O BLK indica a mancha sem o tratamento recombinante com PHI-1. Após incubação na ausência (esquerda) e presença (direita) de 1 mM de ATP, as bolhas foram submetidas a imunodetecção usando anti-P-PHI-1 (Thr57). As pontas de seta para a direita indicam as localizações de P-PHI-1 no painel superior direito. Níveis de brilho e contraste de blots são idênticos.
BG: fundo; WT: tipo selvagem.
com base nestes dados, propomos que o KAT-WB seja capaz de detectar a autofosforilação de Tir cinases e a fosforilação específica do local de proteínas de substrato selectivas de interesse por múltiplas cinases proteicas presentes nos tecidos e células. O KAT-WB partilha essencialmente as vantagens do tradicional ensaio de fosforilação em gel, que detecta as actividades da cinase numa mistura bruta, tais como extractos celulares, expondo as suas dimensões moleculares . Outra vantagem destes dois ensaios é que as modificações pós-translacionais (PTMs) das cinases nas células podem ser preservadas em um ponto de tempo desejado em condições específicas, porque as amostras para estes ensaios são rapidamente desnaturadas com o tampão, incluindo SDS, eliminando fosforilação e desphoforilação nos extratos . A maioria das cinases proteicas são reguladas através de PTM. O KAT-WB é capaz de monitorar as flutuações nas atividades cinase, mesmo que PTMs regulatórios ainda não tenham sido caracterizados. KAT-WB é incapaz de detectar cada cinase em extratos de células porque apenas enzimas monoméricas que se renaturam eficazmente sob as condições empregadas mostram atividade. No entanto, as modificações do KAT-WB devem ser capazes de detectar cinases reguladas pela calmodulina e ciclinas, tal como foi feito através do ensaio de fosforilação em gel . A melhoria da eficiência de renaturação e uma combinação com imunoprecipitação/imunodepleção com anticorpos para cinases podem expandir a utilidade da abordagem.
é digno de nota que, além da fosforilação, o princípio do protocolo KAT-WB pode ser aplicado para a detecção de outras enzimas PTM, tais como acetilases, metilases e ligases ubiquitinas, quando anticorpos PTM específicos estão disponíveis. Juntamente com o desenvolvimento de anticorpos que reconhecem PTMs específicos do local, metas de pesquisa cobertas por atividade marcada western blotting será expandida.
- contribuições dos autores
- agradecimentos
- Este trabalho é apoiado por JSPS KAKENHI (JP19K06573 e JP19H03125) e Society for Research on Umami Taste, funds from Imabari city and Ehime prefecture, and a gift from H Awagi. Os autores não têm outras afiliações relevantes ou envolvimento financeiro com qualquer organização ou entidade com um interesse financeiro ou conflito financeiro com o assunto ou materiais discutidos no manuscrito, além dos divulgados.
- Open access
contribuições dos autores
m Eto, s Katsuki, Y Tanaka e K Takeya conceberam e conceberam as experiências. S Katsuki, y Tanaka e K Takeya conduziram os testes. M Eto, s Katsuki, y Tanaka e K Takeya realizaram a análise de dados. M Eto, s Katsuki, y Tanaka e K Takeya escreveram o artigo.
agradecimentos
os autores gostariam de agradecer DL Brautigan por rever o manuscrito e por sugestões valiosas.
Este trabalho é apoiado por JSPS KAKENHI (JP19K06573 e JP19H03125) e Society for Research on Umami Taste, funds from Imabari city and Ehime prefecture, and a gift from H Awagi. Os autores não têm outras afiliações relevantes ou envolvimento financeiro com qualquer organização ou entidade com um interesse financeiro ou conflito financeiro com o assunto ou materiais discutidos no manuscrito, além dos divulgados.
nenhuma ajuda escrita foi utilizada na produção deste manuscrito.
Open access
This work is licensed under the Attribution-NonCommercial-NoDerivatives 4.0 Unported License. Para ver uma cópia desta licença, visite http://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. Hornbeck PV, Zhang B, Murray B et al. PhosphoSitePlus, 2014: mutações, PTMs e recalibrações. Nucleic Acids Res. 43, D512–D520 (2015).Crossref, Medline, CAS, Google Scholar
- 2. Celenza JL, Carlson M. Renaturação da actividade da proteína cinase em bolhas proteicas. Métodos Enzimol. Academic Press, Cambridge Massachusetts, 34, 423-430 (1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. Renaturação da actividade da proteína cinase dependente do cálcio / calmodulina após transferência electroforética de géis dodecilsulfato de sódio-poliacrilamida para membranas. Anal. Bioquímica. 211(1), 131–138 (1993).Crossref, Medline, CAS, Google Scholar
- 6. Macdonald JA, Borman MA, Muranyi A et al. Identificação da quinase associada à miosina fosfatase do músculo liso endógeno. Procedimento. Natl Acad. Ciência. EUA 98(5), 2419-2424 (2001).Crossref, Medline, CAS, Google Scholar
- 7. Wooten MW. Ensaio in-gel kinase como método para identificar substratos da cinase. Ciência. STKE 2002 (153), pl15 (2002).Medline, Google Scholar
- 8. Celenza J, Carlson M. um gene de levedura essencial para a libertação da repressão da glucose codifica uma cinase proteica. Ciência 233(4769), 1175-1180 (1986).Crossref, Medline, CAS, Google Scholar
- 9. Eto m, Karginov a, Brautigan DL. Um novo inibidor da fosfoproteína do tipo proteico-1, as holoenzimas da fosfatase. Bioquímica 38(51), 16952-16957 (1999).Crossref, Medline, CAS, Google Scholar
- 10. Macdonald JA, Eto m, Borman MA et al. Fosforilação dupla de ser e Thr do IPC-17, um inibidor da fosfatase de miosina, pela cinase associada ao MYPT. FEBS Lett. 493(2–3), 91–94 (2001).Crossref, Medline, CAS, Google Scholar
- 11. Eto m, Leach C, Tountas na et al. Inibidores da fosfoproteína da proteína fosfatase-1. Métodos Enzimol. 366, 243–260 (2003).Medline, CAS, Google Scholar
- 12. Rousell J, Haddad El B, Lindsay MA et al. Regulação da expressão do gene do receptor muscarínico m2 pelo factor de crescimento derivado das plaquetas: envolvimento das cinases proteicas com regulação pelo sinal extracelular no processo de regulação descendente. Mol. Farmacol. 52(6), 966–973 (1997).Crossref, Medline, CAS, Google Scholar