accumulerend bewijs suggereert dat disrupties in fosforylering/defosforylering signalering geassocieerd zijn met pathologisch gedrag van cellen. De Phospho-proteome projecten hebben bijna 300.000 phosphorylated ser/Thr/Tyr residuen in cellulaire proteã nen geà dentificeerd . Parallel, ontdekte het menselijke genoomproject ongeveer 500 eiwitkinasen. Toch is een beperkt aantal eiwitkinasen toegewezen aan elke phosphorylation-plaats.
de in-gel phosphorylation assay is een geschikte methode geweest voor het detecteren van eiwitkinaseactiviteiten in monsters die met SDS zijn opgelost. Deze methode werd toegepast voor de identificatie van CaMKII, MYPT1-K (of ZIPK) en anderen . In dit testprotocol, worden de eiwitkinasen geladen op een SDS-polyacrylamidegel ingebed met een substraatpolypeptide, en dan onderworpen aan renaturation, phosphorylation gebruikend radioactief ATP, gevolgd door autoradiografie om phosphorylated substraat te ontdekken. Daarnaast is autofosforylatie van kinasen gedetecteerd op nitrocellulose of polyvinylideenfluoride (PVDF) membraan met behulp van radioactief ATP . Het radioactieve materiaal kan een beperking zijn voor de gebruikers, als gevolg van veiligheidsvoorschriften. Bovendien missen autoradiogrammen van phosphorylated proteã nen om het even welke informatie van phosphorylation plaatsen.
hier hebben we een nonradioactieve alternatieve test geoptimaliseerd voor de traditionele in-gel fosforylatietest. Genoemd kinase activiteit-geëtiketteerd western blotting (KAT-WB), dit met succes ontdekt Tyr-kinases die autofosforylate zelf evenals Ser/Thr-kinases dat phosphorylate een substraatproteã ne van belang op een specifieke plaats gebruikend phospho (P)-specifieke antilichamen.
figuur 1 toont KAT-WB gegevens voor Tyr-kinase autofosforylatie assay. Om dubbele vlekken te maken, werden twee aliquots van een extract geladen op een polyacrylamidegel van SDS, onderworpen aan elektroforese, en toen werden de proteã nen overgebracht op een blad van PVDF membraan (0.2 µm). Het membraan werd achtereenvolgens behandeld met gebufferde 2-propanol, 6,0 M guanidinehydrochloride (Gu-HCl), 3,0 M Gu-HCl, 0,1 M Gu-HCl en renaturatiebuffer (zie Aanvullend Protocol). Na een nachtelijke renaturatiestap bij 4°C werd het membraan in de lengte gesneden om twee dubbele stukken te genereren (figuur 1). Een stuk membraan werd gedurende 60 min geïncubeerd met 1 mM MgATP. Het andere stuk membraan werd geïncubeerd zonder MgATP, als controle. Beide bladen werden gelijktijdig onderworpen aan immunodetectie met anti-P-Tyr antilichaam (kloon PY20 bij 1:5000 verdunning). Zoals weergegeven in Figuur 1, werden meerdere p-Tyr-banden gedetecteerd bij 100, 70, 45 en 35 kDa in het controlemembraan (linksboven). Deze p-Tyr proteã nen waren vermoedelijk reeds gefosforyleerd vóór extractie. De incubatie met MgATP na scheiding verhoogde Tyr-fosforylering van een eiwit bij 45 kDa in hartspierlysaten( figuur 1, rechtsboven, rijstrook 2), wat wijst op autofosforylering van Tyr-residuen in dit kinase op het membraan na renaturatie. Figuur 1 toont densitogrammen van Baan 2 (- /+MgATP). Om na te gaan of de twee vlekken een gelijkwaardige hoeveelheid eiwit bevatten, werden de filters onderworpen aan coomassie-kleuring (figuur 1, onder). Een technische opmerking is dat, in de loop van de ontwikkeling van de methode, vonden we dat de behandelingen met gebufferde 2-propanol en 6M Gu-HCl beide nodig waren voor de detectie van kinase-activiteiten. Daarom ontdekte KAT-WB een 45-kDa Tyr kinase.

totaal proteïnen van skeletspieren van muizen (31 µg), hartspier (28 µg) en Neuro2a-cellen (27 µg) werden onderworpen aan KAT-western blotting. Na renaturatie, werd het membraan in de lengte in twee gesneden, en elk deel werd geïncubeerd gedurende 60 min bij 37°C in de afwezigheid (links) of aanwezigheid (rechts) van 1 mM ATP. Tyr-fosforylering werd gedetecteerd door een conventionele elektrochemiluminescente methode met behulp van anti-P-Tyr antilichaam (top). Na immunoblotting, werden de totale proteã nen op elke vlek gevisualiseerd door coomassie het bevlekken (bodem). De getallen rechts geven molecuulgewichten aan van markereiwitten (in kDa). Een vak aan de rechterkant geeft densitogrammen van Baan 2 in linker en rechter panelen. Helderheids-en contrastniveaus van vlekken zijn identiek.
een andere versie van KAT-WB gebruikt plaats-specifieke phosphorylation van een substraatproteã ne die op PVDF membraan in nabijheid aan het kinase wordt geabsorbeerd. Wij gebruikten phosphatase holoenzyme inhibitor-1 (PHI-1) als proteã ne van belang, waarvan phosphorylation bij Thr57 dit cellulaire proteã ne in een inhibitor van type-1 ser/thr phosphatase omzet . Figuur 2A toont KAT-WB gegevens met behulp van als positieve controle recombinant ZIPK, een Ser / Thr kinase bekend om fosforylaat recombinant PHI-1 bij Thr57 . Na de denaturatie en het stapsgewijze renaturatieproces werd het membraan ‘ s nachts gedrenkt bij 4°C in de renaturatiebuffer aangevuld met recombinant phi-1 wild type (WT) of een niet-fosforyleerbare versie (T57H) bij 0,2 mg/ml, waarna de fosforyleringsreactie werd uitgevoerd met MgATP. Gefosforyleerde PHI-1 op het membraan werd gedetecteerd met anti-p-PHI-1 (Thr57) antilichaam , en dit toonde een band van de recombinante ZIPK aan. Echter, slechts een zwak signaal werd gedetecteerd op de controle membranen zonder PHI-1 of met de t57h versie van PHI-1. Deze gegevens stellen voor dat renaturated kinases op het membraan aan phosphorylate substraten kunnen zijn die ook op het membraan worden geabsorbeerd. KAT-WB werd toegepast om meerdere PHI-1 kinases in weefsels en cellen te ontdekken (figuur 2B). Extracten van rattenskeletale, hartspieren en Neuro2a-cellen werden onderworpen aan een KAT-WB-test. Vergeleken met no-ATP controle (links, boven), verschenen signalen van P-PHI-1 op de vlek geïncubeerd met 1 mM MgATP (rechts, boven). Prominente banden van P-PHI-1 werden gedetecteerd in Neuro2a cel lysaten bij 100, 60 en 49 kDa (rijstrook 3, open pijlpunt). Er waren echter geen banden voor P-PHI-1 zichtbaar in de rijstrook met de extracten van skeletspieren en hartspieren (rijstroken 1 en 2). Het P-PHI-1 signaal werd niet versterkt door de fosforyleringsstap zonder PHI-1 (Figuur 2, onderkant, blanco: BLK). Deze resultaten tonen aan dat er meerdere PHI-1 kinasen zijn die in neuronale cellen worden uitgedrukt maar niet in skeletachtige of hartspieren. Dit biedt ons een krachtig hulpmiddel voor het detecteren van meerdere substraatspecifieke kinasen in cellen en weefsels. Een technische opmerking is dat de nacht renaturatie met PHI-1 noodzakelijk was voor de detectie van de fosforylatiesignalen, en dat een hogere concentratie van PHI-1 de kleuringsintensiteit niet verhoogde (niet getoond).
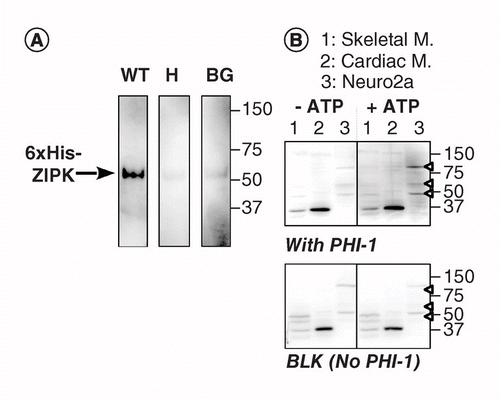
(a) drievoudige blots werden bereid met behulp van recombinant ZIPK, gedeeltelijk gezuiverd uit lysaten van cellen die een 6× His-tagged versie tot expressie brengen. Na elektroblotting en het denaturatie-renaturatieproces werd het membraan ‘ s nachts geïncubeerd met recombinante PHI-1-eiwitten (WT: links; t57h: Midden) bij 0,2 mg/ml of zonder PHI-1 (BG). Elk membraan werd vervolgens geïncubeerd met 1 mM ATP bij 37°C en onderworpen aan immunodetectie met behulp van anti-P-PHI-1 (T57) antilichaam. B) twee duplicaatvlekken (boven en onder) werden bereid met behulp van monsters van totale eiwitten, zoals beschreven in Figuur 1. Recombinant PHI-1 (0,2 mg/ml) werd toegevoegd aan de renaturatiebuffer voor een vlek (top). BLK geeft de vlek aan zonder de recombinant PHI – 1 behandeling. Na incubatie in de afwezigheid (links) en aanwezigheid (rechts) van 1 mM ATP, werden de vlekken onderworpen aan immunodetectie met behulp van anti-P-PHI-1 (Thr57). Pijlpunten rechts geven de locaties aan van P-PHI-1 in het rechterbovenpaneel. Helderheids-en contrastniveaus van vlekken zijn identiek.
BG: Background; WT: Wild-type.
op basis van deze gegevens stellen we voor dat KAT-WB in staat is om autofosforylatie van Tyr-kinasen en plaatsspecifieke fosforylatie van selectieve substraatproteïnen te detecteren die van belang zijn voor meerdere eiwitkinasen die aanwezig zijn in weefsels en cellen. KAT-WB deelt hoofdzakelijk voordelen van de traditionele in-gel phosphorylation analyse, die kinaseactiviteiten in een ruw mengsel, zoals celextracten ontdekt, die hun moleculaire grootte blootstellen . Een ander voordeel van deze twee analyses is dat de post-Vertalende wijzigingen (PTMs) van kinases in cellen op een gewenst tijdstip in specifieke voorwaarden kunnen worden behouden, omdat de steekproeven voor deze analyses snel met de buffer, met inbegrip van SDS worden gedenatureerd, die phosphorylation en dephosphorylation in de extracten elimineren . De meeste eiwitkinasen worden geregeld door PTM. KAT-WB is in staat om fluctuaties in kinase activiteiten te monitoren, zelfs als regulerende PTMs nog moeten worden gekarakteriseerd. KAT-WB is niet in staat om elk kinase in celextracten op te sporen omdat alleen monomere enzymen die effectief renatureren onder de gebruikte omstandigheden activiteit vertonen. Modificaties van KAT-WB moeten echter in staat zijn om kinasen te detecteren die door calmoduline en cyclines worden gereguleerd, zoals dit is gedaan door in-gel fosforylatietest . Verbetering van de renaturatie-efficiëntie en een combinatie met immunoprecipitatie/immunodepletie met antilichamen voor kinasen kunnen het nut van de aanpak vergroten.
het is opmerkelijk dat, naast fosforylering, het principe van KAT-WB-protocol kan worden toegepast voor de detectie van andere PTM-enzymen, zoals acetylasen, methylasen en ubiquitin ligasen, wanneer PTM-specifieke antilichamen beschikbaar zijn. Samen met de ontwikkeling van antilichamen die plaats-specifieke PTMS erkennen, zullen de onderzoeksdoelstellingen door activiteit-geëtiketteerde Westelijke bevlekken worden uitgebreid.
- bijdragen van auteurs
- Dankbetuigingen
- dit werk wordt ondersteund door JSPS KAKENHI (JP19K06573 en JP19H03125) en Society for Research on Umami Taste, fondsen van Imabari city en Ehime prefecture, en een gift van H Awagi. De auteurs hebben geen andere relevante affiliaties of financiële betrokkenheid met een organisatie of entiteit met een financieel belang in of financieel conflict met het onderwerp of materiaal besproken in het manuscript, afgezien van die openbaar gemaakt.
- Open access
bijdragen van auteurs
m Eto, s Katsuki, Y Tanaka en K Takeya ontwierpen en ontwierpen de experimenten. S Katsuki, y Tanaka en K Takeya voerden de tests uit. M Eto, s Katsuki, Y Tanaka en K Takeya hebben de gegevensanalyse uitgevoerd. M Eto, s Katsuki, y Tanaka en K Takeya schreven de krant.
Dankbetuigingen
de auteurs danken DL Brautigan voor het proeflezen van het manuscript en voor waardevolle suggesties.
dit werk wordt ondersteund door JSPS KAKENHI (JP19K06573 en JP19H03125) en Society for Research on Umami Taste, fondsen van Imabari city en Ehime prefecture, en een gift van H Awagi. De auteurs hebben geen andere relevante affiliaties of financiële betrokkenheid met een organisatie of entiteit met een financieel belang in of financieel conflict met het onderwerp of materiaal besproken in het manuscript, afgezien van die openbaar gemaakt.
bij de productie van dit manuscript werd geen gebruik gemaakt van schrijfinstrumenten.
Open access
dit werk is gelicenseerd onder de Naamsvermelding-NietCommercieel-GelijkDelen 4.0 Unported licentie. Om een kopie van deze licentie te bekijken, ga naar http://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. Hornbeck PV, Zhang B, Murray B et al. PhosphoSitePlus, 2014: mutaties, PTMs en herkalibraties. Nucleic Acids Res. 43, D512–D520 (2015).Crossref, Medline, CAS, Google Scholar
- 2. Celenza JL, Carlson M. Renaturation of protein kinase activity on protein blots. Methoden Enzymol. Academic Press, Cambridge Massachusetts, 34, 423-430 (1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. Renaturatie van calcium / calmoduline-afhankelijke eiwitkinaseactiviteit na elektroforetische overdracht van natriumdodecylsulfaat-polyacrylamidegels naar membranen. Anaal. Biochem. 211(1), 131–138 (1993).Crossref, Medline, CAS, Google Scholar
- 6. Macdonald JA, Borman MA, Muranyi A et al. Identificatie van het endogene gladde spier myosine fosfatase-geassocieerde kinase. Proc. Natl Acad. Sci. Verenigde Staten 98(5), 2419-2424 (2001).Crossref, Medline, CAS, Google Scholar
- 7. Wooten MW. In-gel kinase assay als methode om kinasesubstraten te identificeren. Sci. STKE 2002 (153), pl15 (2002).Medline, Google Scholar
- 8. Celenza J, Carlson M. een gist gen dat essentieel is voor de afgifte van glucose onderdrukking codeert een eiwit kinase. Wetenschap 233(4769), 1175-1180 (1986).Crossref, Medline, CAS, Google Scholar
- 9. Eto M, Karginov A, Brautigan DL. Een nieuwe fosfoproteïneremmer van eiwittype-1 fosfatase holoenzymen. Biochemie 38(51), 16952-16957 (1999).Crossref, Medline, CAS, Google Scholar
- 10. Macdonald JA, Eto M, Borman MA et al. Dual ser en THR phosphorylation van CPI-17, een inhibitor van myosin phosphatase, door MYPT-geassocieerd kinase. FEBS Lett. 493(2–3), 91–94 (2001).Crossref, Medline, CAS, Google Scholar
- 11. Eto M, Leach C, Tountas na et al. Fosfoproteïne-remmers van eiwitfosfatase-1. Methoden Enzymol. 366, 243–260 (2003).Medline, CAS, Google Scholar
- 12. Rousell J, Haddad El B, Lindsay MA et al. Regulering van de expressie van het m2-muscarinereceptorgen door van bloedplaatjes afgeleide groeifactor: betrokkenheid van extracellulaire signaalgereguleerde eiwitkinasen bij het downregulatieproces. Mol. Farmacol. 52(6), 966–973 (1997).Crossref, Medline, CAS, Google Scholar