US Pharm. 2014; 39 (4): HS2-HS7.
abstrakt: håndtering af hydrocephalus, ophobning af cerebrospinalvæske (CSF) i hjernens ventrikler inkluderer ofte shuntimplantation for at forhindre langtidsvirkninger. Shunts er dræningsanordninger designet til at opretholde intrakranielt tryk og forhindre yderligere CSF-akkumulering, men de kan introducere patogener i centralnervesystemet. Dette kan føre til infektioner og følgevirkninger, såsom anfald, shuntsvigt, meningitis, sepsis og encephalitis. Infektioner kan forebygges ved hjælp af aseptiske teknikker, kemoprofylakse og/eller antibiotiske eluerende shunts. Behandling af en shuntinfektion kan omfatte fjernelse af det inficerede udstyr, placering af en dræningsanordning og anvendelse af IV eller intraventrikulære antibiotika.
Hydrocephalus er en tilstand, der er kendetegnet ved ophobning af cerebrospinalvæske (CSF) i ventriklerne eller det subarachnoide rum i hjernen, hvilket fører til øget intraventrikulært tryk og ventrikulær udvidelse. En almindelig etiologi af hydrocephalus er svækkelse af CSF-dræning.1,2 forekomsten af hydrocephalus i USA og Europa er blevet estimeret til 0,5 til 0,8 pr.1.000 fødsler og er ofte sekundær til spina bifida, intrakraniel blødning eller medfødt etiologi.1,3 andre potentielle årsager til hydrocephalus omfatter myelodysplasi, tumorer, meningitis, posterior fossa cyste, Dandy-rollator misdannelse eller akveduktal stenose.4
mekanisk shunting er den primære behandling for hydrocephalus. Hydrocephalus-relaterede shuntplaceringer er den mest almindelige neurokirurgiske procedure udført hos børn, men de har også den højeste fejlrate.5 over 40.000 shuntplaceringer udføres årligt i USA med en estimeret dødelighed på 2,7%.5,6 introduktion af almindelig hudflora og andre patogener, både perioperativt og postoperativt, kan føre til shuntinfektioner og resultere i shuntsvigt.
hyppigheden af shuntinfektioner estimeres til 1,6% til 16,7% hos voksne patienter, men op til 20% hos pædiatriske patienter.2,7 denne øgede forekomst i den pædiatriske population antages at skyldes manglende immunitet (især <1 år), prematuritet (<35 ugers svangerskabsalder), eksponering for potentielle patogener, samtidige sygdomme og andre fysiologiske faktorer.3,4 pædiatriske patienter har tendens til at udvikle shuntinfektioner hurtigere end voksne, hvor de fleste infektioner forekommer inden for de første 30 til 60 dage efter placering.1
patienter, der er < 5 år og voksne i alderen 50 Til 59 år, ser ud til at have den største forekomst af shuntinfektioner.1 risikofaktorer for shunt-infektion kan omfatte yngre alder, postoperativ CSF-lækage, intraventrikulær blødning, flere shunts, shunt-revisionskirurgi i de sidste 90 dage, shunts placeret umiddelbart efter meningitis, forlænget hospitalsophold (>1 måned) og tidligere shunt-infektion.2,4,7,8 komplikationer relateret til shunt – infektioner inkluderer shunt-funktionsfejl, kort-eller langvarig kognitiv svækkelse, sepsis, meningitis og forlænget hospitalsophold.1,4,8
Shunttyper
de mest almindelige typer af shunts er opsummeret i tabel 1. Denne artikel vil fokusere på de to mest anvendte shunts: ventriculoperitoneal (VP) og ventriculoatrial (VA) shunts. VP shunts, den mere almindelige af de to, Arbejde ved at omdirigere CSF til bughinden, mens VA shunts flytte CSF til atrium af hjertet.2,9,10

patogenese af Shuntinfektioner
Shuntforurening forårsages ofte, når den proksimale ende af shunten kommer i kontakt med normal hudflora. Dette kan forekomme postoperativt på grund af en sårinfektion eller perioperativt under kirurgisk implantation.11 Gram-positive bakterier, såsom koagulase-negativ Staphylococcus epidermidis og Staphylococcus aureus,er ansvarlige for henholdsvis 45% Til 60% 1-3, 12 og 20% Til 33% 2,3 (med en rapport op til 80% 4) shuntinfektioner. Disse patogener er tæt forbundet med tidlige shuntinfektioner (forekommer inden for 4 uger efter shuntkirurgi).2
sen shunt-infektioner kan forekomme flere måneder efter shunt-operation og tegner sig for cirka 15% af shunt-relaterede infektioner.3 i mange tilfælde kan disse sene infektioner være forårsaget af enten gram-positive bakterier, som Streptococcus-eller Enterococcus-arter, eller gram-negative bakterier, oftest Pseudomonas aeruginosa, hvis patienten har oplevet en tarmperforation eller peritonitis (primært set i VP-shunts).2 de mest almindelige patogener forbundet med shunt-infektioner er opsummeret i tabel 2.1-4,11 infektioner øger sandsynligheden for shunt-relaterede komplikationer og svigt.

forebyggelse af Shuntinfektioner
metoder anvendt til at forhindre en shuntinfektion inkluderer anvendelse af steril teknik, systemiske antibiotika og antibiotikaimprægnerede katetre. Aseptisk kirurgisk teknik har vist sig at hjælpe med at reducere risikoen for shuntinfektioner. En standardiseret kirurgisk protokol, herunder præoperativ vask af patientens hår med shampoo, dobbelthandsker af alle medlemmer af det kirurgiske team og brugen af antibiotiske imprægnerede shunts (AIS), der blev implementeret af fire børnehospitaler, viste en infektionsreduktionshastighed fra 8,8% til 5,7%.13
systemiske profylaktiske antibiotika kan anvendes under proceduren og i de første 24 timer efter shuntplacering. Ifølge en metaanalyse reducerede brugen af systemiske, profylaktiske antibiotika og antibiotiske imprægnerede katetre hastigheden af shuntinfektioner.9 Denne samme undersøgelse sammenlignede brugen af systemiske, profylaktiske antibiotika versus placebo til reduktion af shuntinfektion og fandt , at antibiotika nedsatte antallet af shuntinfektioner (odds ratio, 0,52).9 mens det mest passende profylaktiske antibiotikum til shuntplacering ikke tidligere var veldefineret, bruger de fleste klinikere IV cefasolin eller vancomycin til kirurgisk profylakse.2,14 nylige retningslinjer anbefaler cefasolin til neurokirurgiske fluid-shunting procedurer, med clindamycin og vancomycin som alternativer til allergiske patienter.15
AIS-katetre er ofte blevet brugt til at forhindre shuntinfektioner siden deres introduktion i 2002.16 de fleste enheder er imprægneret med en kombination af rifampicin og clindamycin.4,16,17 de er designet til at målrette koloniseringen af gram-positive bakterier, der producerer en glycoprotein-biofilm, der klæber til kateteroverfladen.16 en metaanalyse undersøgte brugen af antibiotiske imprægnerede katetre versus standardkatetre og fandt ud af, at brugen af antibiotiske imprægnerede katetre var forbundet med nedsat shuntinfektion (OR, 0,21). Det blev konkluderet i denne metaanalyse, at brugen af både systemisk antibiotikaprofylakse og antibiotikaimprægnerede katetre kunne være gavnlig til reduktion af shuntinfektioner.9
et retrospektivt forsøg blev også udført hos pædiatriske patienter, der havde gennemgået shuntindsættelse i løbet af en 3-årig tidsramme. I de første 18 måneder modtog patienter ikke-antibiotisk-imprægnerede katetre; i de næste 18 måneder modtog enhver ny patient, der krævede shuntplacering, antibiotikaimprægnerede katetre. Alle børn blev fulgt i 6 måneder efter shuntplacering. Børnene med ikke-antibiotiske imprægnerede katetre havde en infektionsrate på 12%, mens infektion kun blev set hos 1,4% af børnene med antibiotikaimprægnerede katetre.18 En nyere gennemgang af 15 forsøg konkluderede også, at antibiotikabelagte katetre reducerer den kliniske infektionsrate, især hos patienter, der har langvarige katetre, hvilket var forskelligt fra nogle tidligere analyser.19
forebyggelse af shuntinfektioner gennem profylakse og brug af AIS-katetre har vist sig at reducere omkostningerne ved patientpleje.20 Det anslås, at omkostningerne til behandling af en shuntinfektion kan variere fra $17.300 til $48.454 pr.16,17 selvom hvert AIS-kateter koster i gennemsnit $400, kan mængden af penge, der spares ved at forhindre infektion og/eller reinfektion, give betydelige langsigtede besparelser.16 disse besparelser skyldes en 2,4 gange nedsat Sandsynlighed for infektion og nedsat tid på hospitalet som følge af infektion. Det er blevet rapporteret, at disse besparelser ville beløbe sig til over $440.000 per 100 patienter shunted.17
diagnosticering af Shunt-infektioner
generelle shunt-infektionssymptomer inkluderer hovedpine, kvalme, opkast, betændelse på det kirurgiske sted, neurologisk abnormitet, feber og anfald.2,3 patientspecifikke kliniske manifestationer af shuntinfektioner afhænger af typen af implanteret shunt. VP shunts kan være forbundet med peritonitis, anoreksi, irritabilitet og mavesmerter, 8 mens VA shunts kan være forbundet med sepsis og endokarditis.2,3 hvis der ses kliniske manifestationer såsom ændret mental status, erytem omkring shuntstedet, væske langs shuntsporet, purulent udflod, papilledema, svulmende fontanel, nakkestivhed eller åbenlyst CSF-lækage, skal patienten evalueres med CSF-analyse, blodkulturer og cerebral billeddannelse.8
CSF-analyse, der er forudsigelig for infektion, inkluderer øget antal hvide blodlegemer, øgede proteinkoncentrationer og nedsatte glukoseniveauer; CSF bør også dyrkes og gram-farves. Blodkulturer er mere nyttige indikatorer for VA shunt infektioner i modsætning til VP shunt infektioner.11 Cerebral billeddannelse kan bruges til at identificere ventrikulitis eller tegn på CSF-obstruktion. Abdominal billeddannelse kan også bruges til at identificere VP shunt-funktionsfejl.
behandlingsmuligheder
i øjeblikket er der ingen praksisretningslinjer for behandling af shuntinfektioner; imidlertid er fjernelse af det inficerede udstyr, placering af et eksternt ventrikulært dræn, kulturer og behandling med IV eller intraventrikulær antibiotika alle vist at være en del af en effektiv styringsproces.2
nuværende anbefalinger til empirisk behandling af centralnervesystemet (CNS) infektion i nærvær af en shunt anbefaler at bruge IV vancomycin i kombination med et middel, der har tilstrækkelig gram-negativ dækning, såsom cefepime, ceftasidime, cefotaksime eller meropenem. En medicins evne til at trænge ind i CSF såvel som aktiviteten af antibiotika mod den bakterielle biofilm er også vigtig at overveje For valg af antibiotika.21 sådanne midler bør administreres, indtil patogenet er identificeret og endelig behandling bestemt.22,23 i en VP-shunt ligger den distale spids af shunten inden i bughulen og er mere modtagelig for gram-negative bakterier; gentamicin kan tilsættes for synergi.2 empirisk antimikrobiel terapi og doseringsanbefalinger til shuntinfektioner er opsummeret i tabel 3.2,18,22,23
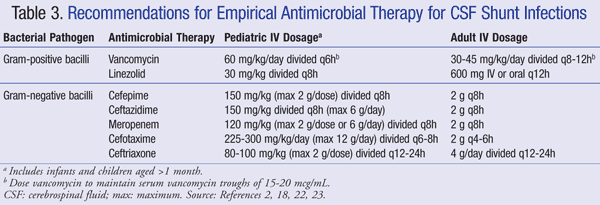
for patienter, der er refraktære over for vancomycinbehandling, har linesolid 10 mg/kg hver 8.time vist sig at være effektiv som monoterapi hos pædiatriske patienter.21 tilsætning af rifampin som supplerende terapi kan også overvejes på grund af dets indtrængning i CNS.24 længden af antibiotikabehandling afhænger i vid udstrækning af den anvendte kirurgiske tilgang, typen af shunt og det involverede patogen, hvor en undersøgelse rapporterer en varighed af terapiområdet på 4 Til 47 dage.25,26 mere specifikt er 7 til 10 dage blevet foreslået til behandlingsvarighed,23 Med et længere forløb (10-14 dage) anbefalet til gram-negative infektioner.2
i tilfælde af komplicerede eller behandlingsresistente shuntinfektioner bør klinikere overveje intratekal eller intraventrikulær administration af antibiotika for øget effekt på grund af deres evne til at opnå højere bakteriedræbende koncentrationer i CNS.23 Vancomycin og gentamicin anvendes almindeligvis i denne situation; der er dog ingen endelige anbefalinger om deres anvendelse.22,23
svampe shunt infektioner
en svampe shunt infektion anses for at være sjælden, med en undersøgelse rapporterer en incidensrate på 0,01%.27 de mest almindelige patogener, der er ansvarlige for en svampeshuntinfektion, er Candida-arter (inklusive C albicans, C parapsilosis og C tropicalis), som forårsager 75% af svampesager. Andre organismer omfatter Histoplasmosis arter, Cryptococcus neoformans og Aspergillus arter. Den primære behandling for svampe shunt infektioner er liposomal amphotericin B 3 til 5 mg/kg/dag i mindst 12 uger.27 for patienter, der er intolerante over for amphotericin B, kan 5-flucytosin være et alternativ.28 Dette efterfølges ofte af behandling med 600 til 800 mg/dag eller 200 mg to til tre gange dagligt i op til 1 år hos immunkompetente patienter og potentielt livslang behandling hos patienter, der er immunkompromitterede.27
konklusion
Shuntinfektioner er en risikofaktor forbundet med hydrocephalusbehandling. Infektionsforebyggelse er påvist med empiriske antibiotika og brugen af AIS-katetre kombineret med korrekt aseptisk teknik for signifikant at reducere infektionshastigheden og reducere risikoen for comorbide følgevirkninger. Der er i øjeblikket ingen retningslinjer for behandling af shuntinfektioner; imidlertid, IV empirisk terapi, der involverer både gram-positiv og gram-negativ dækning, såsom vancomycin og en tredje generation af cephalosporin, ville blive anbefalet. Intraventrikulære antibiotika kan også være nødvendige for maksimal bakteriedræbende CNS-koncentration.
1. Langley JM, grus D, Moore D, et al. Undersøgelse af cerebrospinalvæske shunt-associerede infektioner i det første år efter placering af den canadiske nosokomiale Infektionsovervågning. Inficere Kontrol Hospital Epidemiol. 2009;30:285-288.
2. Brønde DL, Allen JM. Ventrikuloperitoneal shunt infektioner hos voksne patienter. AACN Adv Crit pleje. 2013;24:6-12.
3. Lee JK, Seok JY, Lee JH, et al. Incidens og risikofaktorer for ventrikuloperitoneal shuntinfektioner hos børn: en undersøgelse af 333 på hinanden følgende shunts på 6 år. J Koreansk Med Sci. 2012;27:1563-1568.
4. Parker SL, Attenello FJ, Sciubba DM, et al. Sammenligning af shuntinfektionsforekomst i undergrupper med høj risiko, der modtager antibiotikaimprægneret versus standard shunts. Childs Nervsyst. 2009;25:77-83.
5. Behandling af hydrocephalus. Hydrocephalus Association. – Nej.hydroassoc.org / hydrocephalus-uddannelse-og-støtte/læring-om-hydrocephalus/behandling-af-hydrocephalus/. Adgang Til 11. Februar 2014.
6. Implanterede ventrikulære shunts i USA: omkostningerne til hydrocephalus-behandling på milliarder dollars om året. Neurokirurgi. 2005;56:139-144.
7. Dallacasa P, Dapposo A, Galassi E, et al. Cerebrospinalvæske shunt infektioner hos spædbørn. Childs Nervsyst. 1995;11:643-648.
8. Rogers EA, Kimia a, Madsen JR, et al. Forudsigere for ventrikulær shuntinfektion blandt børn, der præsenterer for en pædiatrisk akutafdeling. Pediatr Emerg Pleje. 2012;28:405-409.
9. Ratilal BO, Costa J, Sampaio C. antibiotisk profylakse til kirurgisk introduktion af intrakranielle ventrikulære shunts. Cochrane Database Syst Rev. 2006; (3): CD005365.
10. Shunt systemer. Hydrocephalus Association. www.hydroassoc.org/hydrocephalus-education-and-support/learning-about-hydrocephalus/shunts. adgang til 12. februar 2014.
11. Fremad KR, færre HD, Stiver HG. Cerebrospinalvæske shunt infektion. En gennemgang af 35 infektioner hos 32 patienter. J Neurosurg. 1983;59:389-394.
12. Lan CC, TT TT, Chen SJ, et al. Tidlig diagnose af ventrikuloperitoneal shunt infektioner og funktionsfejl hos børn med hydrocephalus. J Microbiol Immunol Inficere. 2003;36:47-50.
13. Kestle JR., Riva-Cambrin J. En standardiseret protokol til reduktion af cerebrospinalvæske shunt-infektion: Hydrocephalus klinisk forskningsnetværk Kvalitetsforbedringsinitiativ. J Neurosurg Pediatr. 2011;8:22-29.
14. Shah SS, Sinko-Cochran RL, Keyserling HL, et al. Vancomycin anvendelse i pædiatriske neurokirurgiske patienter. Am J Inficere Kontrol. 1999;27:482-487.
15. Dellinger EP, Olsen KM, Et Al. Retningslinjer for klinisk praksis for antimikrobiel profylakse i kirurgi. Am J Sundhed-Syst Pharm. 2013;70:195-283.
16. Parker SL, Anderson, Lilienfeld S, et al. Cerebrospinal shunt-infektion hos patienter, der får antibiotikaimprægneret versus standard shunts. J Neurosurg Pediatr. 2011;8:259-265.
17. Attenello F, Garces-Ambrossi G, Saidi H, et al. Hospitalsomkostninger forbundet med shuntinfektioner hos patienter, der får antibiotikaimprægnerede shuntkatetre versus standard shuntkatetre. Neurokirurgi. 2010;66:284-289.
18. Sciubba DM, Stuart RM, McGirt MJ, et al. Effekt af antibiotiske imprægnerede shuntkateter ved at mindske forekomsten af shuntinfektion i behandlingen af hydrocephalus. J Neurosurg. 2005; 103 (suppl): 131-136.
19. Babu MA, Patel R, Marsh et al. Strategier for at mindske risikoen for ventrikulære kateterinfektioner: en gennemgang af beviserne. Neurokritisk Pleje. 2012;16:194-202.
20. Dellinger EP, Olsen KM, Et Al. Retningslinjer for klinisk praksis for antimikrobiel profylakse i kirurgi. Surg Inficere (Larchmt). 2013;14:73-156.
21. A, Dalgic N, Musluman M, et al. Behandling af shunt-relaterede cerebrospinalvæskeinfektioner hos børn. J Neurosurg Pediatr. 2010;5:443-448.
22. Tunkel AR, Hartman BJ, Kaplan SL, et al. Øv retningslinjer for håndtering af bakteriel meningitis. Clin Inficere Dis. 2004;39:1267-1284.
23. Van De Beek D, Drake JM, Tunkel AR. Nosokomial bakteriel meningitis. N Engl J Med. 2010;362:146-154.
24. Hedberg A, Hardemark HG, Olsson-Liljekvist B, et al. Penetration af fusidinsyre og rifampicin i cerebrospinalvæske i lav grad inflammatorisk meningitis forårsaget af Staphylococcus epidermidis. Clin Microbiol Inficere. 2004;10:765-768.
25. Antimikrobiel profylakse til kirurgi. Treat Guide Med Lett. 2004;2:27-32.
26. Simon TD, Hall M, Dean JM, et al. Reinfektion efter initial cerebrospinalvæske shunt infektion. J Neurosurg Pediatr. 2010;6:277-285.
27. A, Ludvig C, Camara-Kvintana, et al. Svampeinfektion i en ventrikuloperitoneal shunt: histoplasmosis diagnose og behandling. Verden Neurosurg. 2013;80:222.e5-e13.
28. Chiou CC, TT TT, Lin HH, et al. Svampeinfektion af ventrikuloperitoneale shunts hos børn. Clin Inficere Dis. 1994;19:1049-1053.