US Pharm. 2014; 39 (4): HS2-HS7.
SAMMENDRAG: behandling av hydrocephalus, akkumulering av cerebrospinalvæske (CSF) i hjernens ventrikler, inkluderer ofte shuntimplantasjon for å forhindre langsiktige effekter. Shunter er dreneringsanordninger designet for å opprettholde intrakranielt trykk og forhindre ytterligere CSF-akkumulering, men de kan introdusere patogener i sentralnervesystemet. Dette kan føre til infeksjoner og følger, som anfall, shuntfeil, meningitt, sepsis og encefalitt. Infeksjoner kan forebygges ved bruk av aseptiske teknikker, kjemoprofylakse og/eller antibiotisk eluerende shunter. Behandling av en shunt infeksjon kan omfatte fjerning av infisert maskinvare, plassering av en drenering enhet, og bruk AV IV eller intraventrikulære antibiotika.
Hydrocephalus Er en tilstand preget av akkumulering av cerebrospinalvæske (CSF) i ventriklene eller subaraknoidrommet i hjernen, noe som fører til økt intraventrikulært trykk og ventrikulær dilatasjon. En vanlig etiologi av hydrocephalus er nedsatt CSF-drenering.1,2 forekomsten av hydrocephalus I Usa og Europa er estimert til 0,5 til 0,8 per 1000 fødsler og er ofte sekundær til spina bifida, intrakranial blødning eller medfødt etiologi.1,3 andre mulige årsaker til hydrocephalus inkluderer myelodysplasi, svulster, meningitt, posterior fossa cyste, Dandy-Walker misdannelse, eller akveduktal stenose.4
Mekanisk skifting er den primære behandlingen for hydrocephalus. Hydrocephalus-relaterte shuntplasseringer er den vanligste nevrokirurgiske prosedyren som utføres hos barn, men de har også den høyeste feilfrekvensen.5 Over 40.000 shuntplasseringer utføres årlig i USA, med en estimert pasientdødelighet på 2, 7%.5,6 Innføring av vanlig hudflora og andre patogener, både perioperativt og postoperativt, kan føre til shuntinfeksjoner og resultere i shuntfeil.
frekvensen av shuntinfeksjoner er estimert til 1,6% til 16,7% hos voksne pasienter, men opptil 20% hos pediatriske pasienter.2,7 denne økte forekomsten i den pediatriske populasjonen antas å skyldes manglende immunitet (spesielt < 1 år), prematuritet (< 35 ukers svangerskapsalder), eksponering for potensielle patogener, samtidige morbiditeter og andre fysiologiske faktorer.3,4 Pediatriske pasienter har en tendens til å utvikle shuntinfeksjoner tidligere enn voksne, med de fleste infeksjoner som oppstår innen de første 30 til 60 dagene etter plassering.1
Pasienter som er <5 år og voksne i alderen 50 til 59 år synes å ha størst forekomst av shuntinfeksjoner.1 Risikofaktorer for shuntinfeksjon kan omfatte yngre alder, postoperativ CSF-lekkasje, intraventrikulær blødning, multiple shunter, shunt revisjonskirurgi de siste 90 dagene, shunter plassert umiddelbart etter meningitt, forlenget sykehusopphold (> 1 måned) og tidligere shuntinfeksjon.2,4,7,8 Komplikasjoner relatert til shuntinfeksjoner inkluderer shuntfeil, kort-eller langsiktig kognitiv svekkelse, sepsis, meningitt og forlenget sykehusopphold.1,4,8
Shunttyper
de vanligste typene shunter er oppsummert i TABELL 1. Denne artikkelen vil fokusere på de to mest brukte shunts: ventriculoperitoneal (VP) og ventriculoatrial (VA) shunts. VP shunts, jo mer vanlig av de to, arbeid ved å avlede CSF til bukhinnen, MENS VA shunts skifte CSF til atrium av hjertet.2,9,10

Patogenesen Av Shuntinfeksjoner
shuntkontaminering forårsakes ofte når den proksimale enden av shunten kommer i kontakt med normal hudflora. Dette kan oppstå postoperativt på grunn av en sårinfeksjon eller perioperativt under kirurgisk implantasjon.11 Gram-positive bakterier, som koagulase-negativ staphylococcus epidermidis og Staphylococcus aureus, er ansvarlige for henholdsvis 45% til 60% 1-3,12 og 20% til 33% 2,3 (med en rapport opptil 80% 4) av shuntinfeksjoner. Disse patogenene er nært forbundet med tidlige shuntinfeksjoner (forekommer innen 4 uker etter shuntoperasjon).2
Sene shuntinfeksjoner kan oppstå flere måneder etter shuntoperasjonen og utgjør ca.15% av shuntrelaterte infeksjoner.3 i mange tilfeller kan disse sene infeksjonene skyldes enten gram-positive bakterier, Som Streptokokker eller Enterokokker, eller gram-negative bakterier, oftest Pseudomonas aeruginosa, hvis pasienten har opplevd tarmperforasjon eller peritonitt (hovedsakelig sett I VP-shunter).2 de vanligste patogener assosiert med shunt infeksjoner er oppsummert I TABELL 2.1 – 4,11 Infeksjoner øke sannsynligheten for shunt-relaterte komplikasjoner og svikt.

Forebygging Av Shuntinfeksjoner
Metoder som brukes for å forhindre en shuntinfeksjon, inkluderer bruk av steril teknikk, systemiske antibiotika og antibiotikumimpregnerte katetre. Aseptisk kirurgisk teknikk har vist seg å bidra til å redusere risikoen for shuntinfeksjoner. En standardisert kirurgisk protokoll, inkludert preoperativ vasking av pasientens hår med klorhexidinsjampo, dobbel hansker av alle medlemmer av det kirurgiske teamet, og bruken av antibiotikaimpregnerte shunter (AIS), som ble implementert av fire barnehospitaler, viste en infeksjonsreduksjonsrate fra 8,8% til 5,7%.13
Systemisk profylaktisk antibiotika kan benyttes under prosedyren og i de første 24 timene etter shuntplassering. Ifølge en meta-analyse reduserte bruken av systemiske, profylaktiske antibiotika og antibiotikumimpregnerte katetre frekvensen av shuntinfeksjoner.9 Den samme studien sammenlignet bruk av systemiske, profylaktiske antibiotika mot placebo for reduksjon av shuntinfeksjon og fant at antibiotika reduserte forekomsten av shuntinfeksjoner (odds ratio , 0,52).9 selv om det mest hensiktsmessige profylaktiske antibiotikumet for shuntplassering ikke var godt definert tidligere, bruker de FLESTE klinikere iv cefazolin eller vankomycin TIL kirurgisk profylakse.2,14 Nyere retningslinjer anbefaler cefazolin for nevrokirurgiske fluid-shunting prosedyrer, med clindamycin og vancomycin som alternativer for allergiske pasienter.15
AIS-katetre har ofte blitt brukt til å forhindre shuntinfeksjoner siden introduksjonen i 2002.16 De Fleste enheter er impregnert med en kombinasjon av rifampicin og clindamycin.4,16,17 De er designet for å målrette kolonisering av gram-positive bakterier som produserer en glykoprotein biofilm som fester seg til kateteroverflaten.16 en meta-analyse så på bruken av antibiotikaimpregnerte katetre versus standardkatetre og fant at bruken av antibiotikaimpregnerte katetre var assosiert med reduserte mengder shuntinfeksjon (OR, 0.21). Det ble konkludert i denne metaanalysen at bruk av både systemisk antibiotikaprofylakse og antibiotikainpregnerte katetre kan være gunstig for reduksjon av shuntinfeksjoner.9
en retrospektiv studie ble også utført hos pediatriske pasienter som hadde gjennomgått shuntinnsetting i løpet av en 3-års tidsramme. I de første 18 månedene fikk pasientene nonantibiotic-impregnerte katetre; i de neste 18 månedene fikk enhver ny pasient som trengte shuntplassering antibiotika-impregnerte katetre. Alle barn ble fulgt i 6 måneder etter shuntplassering. Barna med ikke-antibiotika-impregnerte katetre hadde en infeksjonsrate på 12%, mens infeksjon ble sett hos bare 1,4% av barna med antibiotisk-impregnerte katetre.18 En nyere gjennomgang av 15 studier konkluderte også med at antibiotika-belagte katetre reduserer den kliniske infeksjonsraten, spesielt hos pasienter som har langsiktige katetre, noe som var forskjellig fra noen tidligere analyser.19
Forebygging av shuntinfeksjoner gjennom profylakse og BRUK AV ais-katetre har vist seg å redusere kostnadene ved pasientbehandling.20 det anslås at kostnaden for å behandle en shuntinfeksjon kan variere fra $ 17.300 til $48.454 per pasient, noe som fører til en estimert årlig sykehuspris i USA på $2 milliarder.16,17 selv om hvert AIS-kateter koster et gjennomsnitt på $400, kan mengden penger spart ved å forhindre infeksjon og/eller reinfeksjon gi betydelige langsiktige besparelser.16 disse besparelsene skyldes en 2,4 ganger redusert sannsynlighet for infeksjon og redusert tid på sykehuset som følge av infeksjon. Det har blitt rapportert at disse besparelsene vil beløpe seg til over $440 000 per 100 pasienter shunted.17
Diagnostisering Av Shuntinfeksjoner
Generelle shuntinfeksjonssymptomer inkluderer hodepine, kvalme, oppkast, betennelse på operasjonsstedet, nevrologisk abnormitet, feber og anfall.2,3 Pasientspesifikke kliniske manifestasjoner av shuntinfeksjoner avhenger av typen shunt implantert. VP shunter kan være forbundet med peritonitt, anoreksi, irritabilitet og magesmerter, 8 MENS VA shunter kan være forbundet med sepsis og endokarditt.2,3 dersom kliniske manifestasjoner som endret mental status, erytem rundt shuntstedet, væske langs shuntbanen, purulent utflod, papilledema, svulmende fontanel, nakkestivhet eller åpenbar csf-lekkasje ses, skal pasienten evalueres med CSF-analyse, blodkulturer og cerebral avbildning.8
CSF analyse prediktiv for infeksjon inkluderer økt antall hvite blodlegemer, økte proteinkonsentrasjoner og reduserte glukosenivåer; CSF bør også dyrkes og gram-farget. Blodkulturer er mer nyttige indikatorer PÅ VA shunt infeksjoner i motsetning TIL VP shunt infeksjoner.11 Cerebral imaging kan brukes til å identifisere ventrikulitt eller tegn på CSF-obstruksjon. Abdominal imaging kan også brukes til å identifisere VP shunt feil.
Behandlingsalternativer
For Tiden er det Ingen praksis retningslinjer for behandling av shunt infeksjoner; men fjerning av infisert maskinvare, plassering av en ekstern ventrikulær avløp, kulturer, og behandling MED IV eller intraventrikulære anti-biotika er alle vist å være en del av en effektiv behandlingsprosess.2
Nåværende anbefalinger for empirisk behandling av cns-infeksjon i nærvær av en shunt anbefaler BRUK AV iv vancomycin i kombinasjon med et middel som har tilstrekkelig gram-negativ dekning, som cefepim, ceftazidim, cefotaxim eller meropenem. Evnen til en medisin til å trenge INN I CSF, samt antibiotikaens aktivitet mot bakteriell biofilm, er også viktig å vurdere for antibiotisk valg.21 Slike midler skal administreres til patogenet er identifisert og endelig behandling bestemt.22,23 I EN VP shunt ligger den distale spissen av shunten i bukhulen og er mer utsatt for gram-negative bakterier; gentamicin kan tilsettes for synergi.2 Empirisk antimikrobiell behandling og doseringsanbefalinger for shuntinfeksjoner er oppsummert I TABELL 3.2,18,22,23
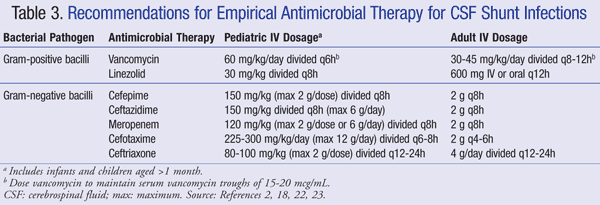
hos pasienter som er refraktære overfor vankomycinbehandling, har linezolid 10 mg/kg hver 8. time vist seg å være effektiv som monoterapi hos pediatriske pasienter.21 tillegg av rifampicin som tilleggsbehandling kan også vurderes på grunn av penetrering i CNS.24 lengden på antibiotikabehandling avhenger i stor grad av den kirurgiske tilnærmingen som brukes, typen shunt og det involverte patogenet, med en studie som rapporterte en varighet av behandlingsområdet på 4 til 47 dager.25,26 Mer spesifikt har 7 til 10 dager blitt foreslått for behandlingsvarighet, 23 med lengre kurs (10-14 dager) anbefalt for gram-negative infeksjoner.2
ved kompliserte eller behandlingsresistente shuntinfeksjoner bør klinikere vurdere intratekal eller intraventrikulær administrering av antibiotika for økt effekt på grunn av deres evne til å oppnå høyere bakteriedrepende konsentrasjoner i CNS.23 Vancomycin og gentamicin brukes ofte i denne situasjonen; det er imidlertid ingen endelige anbefalinger om bruken av dem.22,23
Sopp Shuntinfeksjoner
en sopp shuntinfeksjon anses å være sjelden, med en studie som rapporterte en insidensrate på 0,01%.27 De vanligste patogener som er ansvarlige for en sopp shunt infeksjon Er Candida arter (inkludert c albicans, c parapsilosis, og c tropicalis), som forårsaker 75% av sopp tilfeller. Andre organismer inkluderer Histoplasmose arter, Cryptococcus neoformans, Og Aspergillus arter. Den primære behandlingen for sopp shuntinfeksjoner er liposomal amfotericin B 3 til 5 mg / kg / dag i minst 12 uker.27 for pasienter som er intolerante overfor amfotericin B, kan 5-flucytosin være et alternativ.28 dette etterfølges ofte av behandling med flukonazol 600 til 800 mg/dag eller itrakonazol 200 mg to til tre ganger daglig i opptil 1 år hos immunkompetente pasienter og potensielt livslang behandling hos immunkompromitterte pasienter.27
Konklusjon
shuntinfeksjoner er en risikofaktor forbundet med hydrocephalusbehandling. Infeksjonsforebygging er vist med empiriske antibiotika og BRUK av ais-katetre, kombinert med riktig aseptisk teknikk, for å redusere infeksjonsraten betydelig og redusere risikoen for komorbide følgetilstander. DET er for tiden ingen retningslinjer for behandling av shuntinfeksjoner, MEN iv empirisk terapi som involverer både gram-positiv og gram-negativ dekning, som vancomycin og tredjegenerasjons cefalosporin, vil bli anbefalt. Intraventrikulære antibiotika kan også være nødvendig for maksimal bakteriedrepende CNS-konsentrasjon.
1. Langley JM, Grus D, Moore D, Et al. Studie av cerebrospinalvæske shuntassosierte infeksjoner i det første året etter plassering, Ved Canadian Nosocomial Infection Surveillance. Infect Control Sykehus Epidemiol. 2009;30:285-288.
2. Wells DL, Allen JM. Ventrikuloperitoneal shuntinfeksjoner hos voksne pasienter. Aacn Adv Crit Omsorg. 2013;24:6-12.
3. Lee JK, Seok JY, Lee JH, et al. Forekomst og risikofaktorer for ventrikuloperitoneal shuntinfeksjoner hos barn: en studie av 333 påfølgende shunter på 6 år. J Koreansk Med Sci. 2012;27:1563-1568.
4. Parker SL, Attenello FJ, Sciubba DM, Et al. Sammenligning av forekomst av shuntinfeksjon i høyrisikoundergrupper som fikk antibiotikaimpregnert versus standard shunter. Childs Nerv Syst. 2009;25:77-83.
5. Behandling av hydrocephalus. Hydrocephalus Forening. www.hydroassoc.org / hydrocephalus-utdanning-og-støtte / læring-om-hydrocephalus / behandling-av-hydrocephalus/. Besøkt 11.Februar 2014.
6. Patwardhan RV, Nanda A. Implantert ventrikulære shunts I Usa: milliard-dollar-a-års kostnaden for hydrocephalus behandling. Nevrokirurgi. 2005;56:139-144.
7. A, Et al. Cerebrospinalvæske shunt infeksjoner hos spedbarn. Childs Nerv Syst. 1995;11:643-648.
8. Rogers EA, Kimia A, Madsen JR., et al. Prediktorer av ventrikulær shuntinfeksjon blant barn som presenterer til en pediatrisk beredskapsavdeling. Pediatr Emerg Omsorg. 2012;28:405-409.
9. Ratilal BO, Costa J, Sampaio C. antibiotikaprofylakse for kirurgisk innføring av intrakranielle ventrikulære shunter. Cochrane Database Syst Rev. 2006; (3):CD005365.
10. Shunt systems. Hydrocephalus Forening. www.hydroassoc.org/hydrocephalus-education-and-support/learning-about-hydrocephalus/shunts. Besøkt 12.februar 2014.
11. Fremover KR, Færre HD, Stiver HG. Cerebrospinalvæske shunt infeksjon. En gjennomgang av 35 infeksjoner hos 32 pasienter. J Nevrokirurg. 1983;59:389-394.
12. Lan CC, Wong TT, Chen SJ, et al. Tidlig diagnose av ventrikuloperitoneal shuntinfeksjoner og funksjonsfeil hos barn med hydrocephalus. J Mikrobiol Immunol Infisere. 2003;36:47-50.
13. Kestle JR, Riva-Cambrin J, Wellons JC, et al. En standardisert protokoll for å redusere cerebrospinalvæske shunt infeksjon: Hydrocephalus Clinical Research Network Quality Improvement Initiative. J Neurosurg Pediatr. 2011;8:22-29.
14. Shah SS, Sinkowitz-Cochran RL, Keyserling HL, et al. Vancomycin bruk hos pediatriske nevrokirurgipasienter. Am J Infisere Kontroll. 1999;27:482-487.
15. Jørgensen DW, DELLINGER EP, Olsen KM, et al. Klinisk praksis retningslinjer for antimikrobiell profylakse i kirurgi. Am J Helse-Syst Pharm. 2013;70:195-283.
16. Parker SL, Anderson WN, Lilienfeld S, et al. Cerebrospinal shunt infeksjon hos pasienter som får antibiotikaimpregnert versus standard shunter. J Neurosurg Pediatr. 2011;8:259-265.
17. Jørgensen F, Jørgensen F, jørgensen f, et al. Sykehuskostnader forbundet med shuntinfeksjoner hos pasienter som får antibiotikaimpregnerte shuntkatetre versus standard shuntkatetre. Nevrokirurgi. 2010;66:284-289.
18. Scubba DM, Stuart RM, McGirt MJ, et al. Effekt av antibiotika-impregnert shunt katetre i å redusere forekomsten av shunt infeksjon i behandling av hydrocephalus. J Nevrokirurg. 2005; 103 (suppl): 131-136.
19. R, Marsh WR, et al. Strategier for å redusere risikoen for ventrikulære kateterinfeksjoner: en gjennomgang av bevisene. Neurocrit Omsorg. 2012;16:194-202.
20. Jørgensen DW, DELLINGER EP, Olsen KM, et al. Klinisk praksis retningslinjer for antimikrobiell profylakse i kirurgi. Surg Infect (Lerkmt). 2013;14:73-156.
21. Yilmaz A, Dalgic N, Musluman M, Et al. Linezolid behandling av shuntrelaterte cerebrospinalvæskeinfeksjoner hos barn. J Neurosurg Pediatr. 2010;5:443-448.
22. Jørgensen, Jørgensen B. J., Et al. Praksis retningslinjer for behandling av bakteriell meningitt. Clin Infisere Dis. 2004;39:1267-1284.
23. Van De Beek D, Drake JM, Tunkel AR. Nosokomial bakteriell meningitt. N Engl J Med. 2010;362:146-154.
24. Hedberg A, Hardemark HG, Olsson-Liljequist B, et al. Penetrasjon av fusidinsyre og rifampicin i cerebrospinalvæske i lavgradig inflammatorisk meningitt forårsaket Av Staphylococcus epidermidis. Clin Mikrobiol Infiserer. 2004;10:765-768.
25. Antimikrobiell profylakse for kirurgi. Unn Guide Med Lett. 2004;2:27-32.
26. Simon TD, Hall M, Dean JM, et al. Reinfeksjon etter innledende cerebrospinalvæske shunt infeksjon. J Neurosurg Pediatr. 2010;6:277-285.
27. Veeravagu A, Ludwig C, Camara-Quintana JQ, et al. Svampinfeksjon av ventrikuloperitoneal shunt: histoplasmose diagnose og behandling. Verden Nevrokirurg. 2013;80:222.e5-e13.
28. Chiou CC, Wong TT, Lin HH, et al. Svampinfeksjon av ventrikuloperitoneal shunts hos barn. Clin Infisere Dis. 1994;19:1049-1053.