US Pharm. 2014; 39 (4): HS2-HS7.
sammanfattning: hanteringen av hydrocephalus, ackumulering av cerebrospinalvätska (CSF) i hjärnans ventrikel, inkluderar ofta shuntimplantation för att förhindra långsiktiga effekter. Shunts är dräneringsanordningar utformade för att upprätthålla intrakraniellt tryck och förhindra ytterligare CSF-ackumulering, men de kan införa patogener i centrala nervsystemet. Detta kan leda till infektioner och följder, såsom anfall, shuntfel, meningit, sepsis och encefalit. Infektioner kan förebyggas genom att använda aseptiska tekniker, kemoprofylax och/eller antibiotikaelutande shuntar. Behandling av en shuntinfektion kan innefatta avlägsnande av den infekterade hårdvaran, placering av en dräneringsanordning och användning av IV-eller intraventrikulära antibiotika.
Hydrocephalus är ett tillstånd som kännetecknas av ackumulering av cerebrospinalvätska (CSF) i ventriklarna eller subaraknoidutrymmet i hjärnan, vilket leder till ökat intraventrikulärt tryck och ventrikulär utvidgning. En vanlig etiologi av hydrocephalus är försämring av CSF-dränering.1,2 förekomsten av hydrocephalus i USA och Europa har uppskattats till 0,5 till 0,8 per 1 000 födda och är ofta sekundär till spina bifida, intrakraniell blödning eller medfödd etiologi.1,3 andra potentiella orsaker till hydrocephalus inkluderar myelodysplasi, tumörer, meningit, bakre fossacyst, Dandy-Walker missbildning eller akveduktal stenos.4
mekanisk växling är den primära behandlingen för hydrocefalus. Hydrocephalus-relaterade shuntplaceringar är den vanligaste neurokirurgiska proceduren som utförs hos barn, men de har också den högsta felfrekvensen.5 över 40 000 shuntplaceringar utförs årligen i USA, med en beräknad dödlighet på 2,7%.5,6 introduktion av vanlig hudflora och andra patogener, både perioperativt och postoperativt, kan leda till shuntinfektioner och resultera i shuntsvikt.
frekvensen av shuntinfektioner uppskattas till 1, 6% till 16, 7% hos vuxna patienter men upp till 20% hos barn.2,7 denna ökade förekomst i den pediatriska populationen tros bero på brist på immunitet (särskilt <1 års ålder), prematuritet (<35 veckors graviditetsålder), exponering för potentiella patogener, samtidiga sjukligheter och andra fysiologiska faktorer.3,4 pediatriska patienter tenderar att utveckla shuntinfektioner tidigare än vuxna, med de flesta infektioner som inträffar inom de första 30 till 60 dagarna efter placering.1
patienter som är < 5 år och vuxna i åldern 50 till 59 år verkar ha den största förekomsten av shuntinfektioner.1 riskfaktorer för shuntinfektion kan inkludera yngre ålder, postoperativ CSF-läckage, intraventrikulär blödning, flera shuntar, shuntrevisionskirurgi under de senaste 90 dagarna, shuntar placerade omedelbart efter meningit, långvarig sjukhusvistelse (>1 månad) och tidigare shuntinfektion.2,4,7,8 komplikationer relaterade till shuntinfektioner inkluderar shuntfel, kort – eller långvarig kognitiv försämring, sepsis, hjärnhinneinflammation och förlängd sjukhusvistelse.1,4,8
Shunttyper
de vanligaste typerna av shuntar sammanfattas i tabell 1. Denna artikel kommer att fokusera på de två mest använda shunterna: ventriculoperitoneal (VP) och ventriculoatrial (VA) shunts. VP-shuntar, desto vanligare av de två, fungerar genom att avleda CSF till bukhinnan, medan VA-shuntar flyttar CSF till hjärtats atrium.2,9,10

patogenes av Shuntinfektioner
shuntkontaminering orsakas ofta när den proximala änden av shunten kommer i kontakt med normal hudflora. Detta kan inträffa postoperativt på grund av en sårinfektion eller perioperativt under kirurgisk implantation.11 Gram-positiva bakterier, såsom koagulasnegativa Staphylococcus epidermidis och Staphylococcus aureus, är ansvariga för 45% till 60% 1-3,12 och 20% till 33% 2,3 (med en rapport upp till 80% 4) av shuntinfektioner. Dessa patogener är nära associerade med tidiga shuntinfektioner (förekommer inom 4 veckor efter shuntoperation).2
sena shuntinfektioner kan inträffa flera månader efter shuntoperation och står för cirka 15% av shuntrelaterade infektioner.3 i många fall kan dessa sena infektioner orsakas av antingen gram-positiva bakterier, som streptokocker eller enterokocker, eller gramnegativa bakterier, oftast Pseudomonas aeruginosa, om patienten har upplevt tarmperforering eller peritonit (främst sett i VP-shuntar).2 de vanligaste patogenerna associerade med shuntinfektioner sammanfattas i tabell 2.1-4,11 infektioner ökar sannolikheten för shuntrelaterade komplikationer och misslyckanden.

förebyggande av Shuntinfektioner
metoder som används för att förhindra en shuntinfektion inkluderar användning av steril teknik, systemiska antibiotika och antibiotikaimpregnerade katetrar. Aseptisk kirurgisk teknik har visat sig bidra till att minska risken för shuntinfektioner. Ett standardiserat kirurgiskt protokoll, inklusive preoperativ tvättning av patientens hår med klorhexidinschampo, dubbel Handskar av alla medlemmar i det kirurgiska teamet och användningen av antibiotikaimpregnerade shuntar (AIS), som implementerades av fyra barnsjukhus visade en infektionsreduceringshastighet från 8,8% till 5,7%.13
systemiska profylaktiska antibiotika kan användas under proceduren och under de första 24 timmarna efter shuntplacering. Enligt en metaanalys minskade användningen av systemiska, profylaktiska antibiotika och antibiotikaimpregnerade katetrar frekvensen av shuntinfektioner.9 samma studie jämförde användningen av systemiska, profylaktiska antibiotika jämfört med placebo för minskning av shuntinfektion och fann att antibiotika minskade frekvensen av shuntinfektioner (oddskvot , 0.52).9 medan det mest lämpliga profylaktiska antibiotikumet för shuntplacering inte var väl definierat tidigare, använder de flesta kliniker IV cefazolin eller vankomycin för kirurgisk profylax.2,14 nya riktlinjer rekommenderar cefazolin för neurokirurgisk vätske-shunting förfaranden, med klindamycin och vankomycin som alternativ för allergiska patienter.15
AIS-katetrar har vanligtvis använts för att förhindra shuntinfektioner sedan introduktionen 2002.16 de flesta enheter är impregnerade med en kombination av rifampicin och clindamycin.4,16,17 de är utformade för att rikta sig mot koloniseringen av gram-positiva bakterier som producerar en glykoproteinbiofilm som fäster vid kateterytan.16 En metaanalys tittade på användningen av antibiotikaimpregnerade katetrar kontra standardkatetrar och fann att användningen av antibiotikaimpregnerade katetrar var associerad med minskade hastigheter av shuntinfektion (OR, 0.21). Det drogs slutsatsen i denna metaanalys att användningen av både systemisk antibiotikaprofylax och antibiotikaimpregnerade katetrar kan vara till nytta vid minskning av shuntinfektioner.9
en retrospektiv studie genomfördes också hos barn som hade genomgått shuntinsättning under en 3-årig tidsram. Under de första 18 månaderna fick patienter icke-antibiotikaimpregnerade katetrar; under de kommande 18 månaderna fick alla nya patienter som krävde shuntplacering antibiotikaimpregnerade katetrar. Alla barn följdes i 6 månader efter shuntplacering. Barnen med icke-antibiotikaimpregnerade katetrar hade en infektionshastighet på 12%, medan infektion sågs hos endast 1,4% av barnen med antibiotikaimpregnerade katetrar.18 en nyare granskning av 15 studier drog också slutsatsen att antibiotikabelagda katetrar minskar den kliniska infektionshastigheten, särskilt hos patienter som har långvariga katetrar, vilket skilde sig från vissa tidigare analyser.19
förebyggande av shuntinfektioner genom profylax och användning av AIS-katetrar har visat sig minska kostnaden för patientvård.20 Det uppskattas att kostnaden för att behandla en shuntinfektion kan sträcka sig från $17,300 till $48,454 per patient, vilket leder till en beräknad årlig sjukhuskostnad i USA på $2 miljarder.16,17 även om varje AIS-kateter kostar i genomsnitt $ 400, kan mängden pengar som sparas genom att förhindra infektion och/eller återinfektion ge betydande långsiktiga besparingar.16 dessa besparingar beror på en 2,4-faldig minskad sannolikhet för infektion och minskad tid på sjukhuset till följd av infektion. Det har rapporterats att dessa besparingar skulle uppgå till över $440,000 per 100 patienter shuntade.17
diagnostisera Shuntinfektioner
allmänna shuntinfektionssymtom inkluderar huvudvärk, illamående, kräkningar, inflammation i det kirurgiska stället, neurologisk abnormitet, feber och anfall.2,3 patientspecifika kliniska manifestationer av shuntinfektioner beror på typen av implanterad shunt. VP-shuntar kan associeras med peritonit, anorexi, irritabilitet och buksmärta, 8 medan VA-shuntar kan associeras med sepsis och endokardit.2,3 om kliniska manifestationer såsom förändrad mental status, erytem som omger shuntplatsen, vätska längs shuntspåret, purulent urladdning, papilledema, utbuktande fontanel, nackstyvhet eller uppenbart CSF-läckage ses, bör patienten utvärderas med CSF-analys, blodkulturer och cerebral avbildning.8
CSF-analys prediktiv för infektion inkluderar ökat antal vita blodkroppar, ökade proteinkoncentrationer och minskade glukosnivåer; CSF bör också odlas och gramfärgas. Blodkulturer är mer användbara indikatorer på VA-shuntinfektioner i motsats till VP-shuntinfektioner.11 Cerebral avbildning kan användas för att identifiera ventrikulit eller bevis på CSF-obstruktion. Abdominal avbildning kan också användas för att identifiera VP shuntfel.
behandlingsalternativ
för närvarande finns det inga praktiska riktlinjer för behandling av shuntinfektioner; emellertid är borttagning av den infekterade hårdvaran, placering av ett externt ventrikulärt avlopp, kulturer och behandling med IV eller intraventrikulär antibiotik alla visat sig vara en del av en effektiv hanteringsprocess.2
nuvarande rekommendationer för empirisk behandling av infektion i centrala nervsystemet (CNS) i närvaro av en shunt rekommenderar att du använder IV vankomycin i kombination med ett medel som har tillräcklig gramnegativ täckning, såsom cefepim, Ceftazidim, cefotaxim eller meropenem. Förmågan hos ett läkemedel att penetrera CSF såväl som antibiotikans aktivitet mot bakteriell biofilm är också viktigt att överväga för antibiotikaval.21 sådana medel bör administreras tills patogenen har identifierats och definitiv behandling har fastställts.22,23 i en VP-shunt ligger den distala spetsen av shunten i bukhålan och är mer mottaglig för gramnegativa bakterier; gentamicin kan tillsättas för synergi.2 empirisk antimikrobiell terapi och doseringsrekommendationer för shuntinfektioner sammanfattas i tabell 3.2,18,22,23
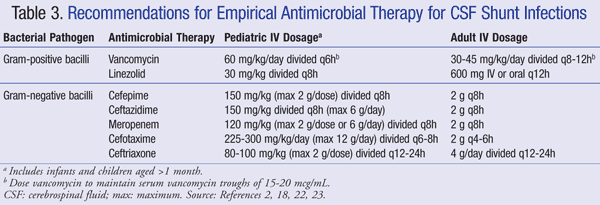
för patienter som är eldfasta mot vankomycinbehandling har linezolid 10 mg/kg var 8: e timme visat sig vara effektivt som monoterapi hos barn.21 tillägg av rifampin som tilläggsbehandling kan också övervägas på grund av dess penetration i CNS.24 längden på antibiotikabehandling beror till stor del på det kirurgiska tillvägagångssätt som används, typen av shunt och patogenen, med en studie som rapporterar en behandlingstid på 4 till 47 dagar.25,26 mer specifikt har 7 till 10 dagar föreslagits för behandlingstid,23 Med en längre kurs (10-14 dagar) rekommenderas för gramnegativa infektioner.2
vid komplicerade eller behandlingsresistenta shuntinfektioner bör kliniker överväga intratekal eller intraventrikulär administrering av antibiotika för ökad effekt på grund av deras förmåga att uppnå högre bakteriedödande koncentrationer inom CNS.23 vankomycin och gentamicin används ofta i denna situation; Det finns dock inga definitiva rekommendationer om deras användning.22,23
svamp Shuntinfektioner
en svamp shuntinfektion anses vara sällsynt, med en studie som rapporterar en incidens på 0,01%.27 de vanligaste patogenerna som är ansvariga för en svamp shuntinfektion är Candida-arter (inklusive C albicans, C parapsilosis och C tropicalis), vilket orsakar 75% av svampfallen. Andra organismer inkluderar histoplasmosis arter, Cryptococcus neoformans och Aspergillus arter. Den primära behandlingen för svamp shuntinfektioner är liposomalt amfotericin B 3 till 5 mg/kg/dag i minst 12 veckor.27 för patienter som är intoleranta mot amfotericin B kan 5-flucytosin vara ett alternativ.28 detta följs ofta av behandling med flukonazol 600 till 800 mg/dag eller itrakonazol 200 mg två till tre gånger dagligen i upp till 1 år hos immunkompetenta patienter och potentiellt livslång behandling hos patienter med nedsatt immunförsvar.27
slutsats
Shuntinfektioner är en riskfaktor associerad med hydrocephalusbehandling. Infektionsprevention har visats med empiriska antibiotika och användning av AIS-katetrar, kombinerat med korrekt aseptisk teknik, för att avsevärt minska infektionshastigheten och minska risken för comorbida följder. Det finns för närvarande inga riktlinjer för behandling av shuntinfektioner; emellertid, IV empirisk terapi som involverar både gram-positiv och gramnegativ täckning, såsom vankomycin och en tredje generationens cefalosporin, skulle rekommenderas. Intraventrikulära antibiotika kan också behövas för maximal bakteriedödande CNS-koncentration.
1. Langley JM, grus D, Moore D, et al. Studie av cerebrospinalvätska shunt – associerade infektioner under det första året efter placering, av den kanadensiska nosokomiala Infektionsövervakningen. Smitta Kontroll Sjukhus Epidemiol. 2009;30:285-288.
2. Wells DL, Allen JM. Ventrikuloperitoneala shuntinfektioner hos vuxna patienter. AACN Adv Crit Vård. 2013;24:6-12.
3. Han är en av de mest kända. Incidens och riskfaktorer för ventrikuloperitoneala shuntinfektioner hos barn: en studie av 333 på varandra följande shuntar på 6 år. J Koreanska Med Sci. 2012;27:1563-1568.
4. Det finns många olika typer av produkter. Jämförelse av shuntinfektionsincidens i högriskundergrupper som får antibiotikaimpregnerade kontra standard shuntar. Childs Nerv Syst. 2009;25:77-83.
5. Behandling av hydrocephalus. Hydrocephalus Association. www.hydroassoc.org / hydrocephalus-utbildning-och-stöd/lärande-om-hydrocephalus/behandling-av-hydrocephalus/. Åtkomst 11 Februari 2014.
6. Patwardhan RV, Nanda A. implanterade ventrikulära shuntar i USA: miljarder dollar per år kostnaden för hydrocephalusbehandling. Neurokirurgi. 2005;56:139-144.
7. Det är en av de mest populära. Cerebrospinalvätskeshuntinfektioner hos spädbarn. Childs Nerv Syst. 1995;11:643-648.
8. Rogers EA, Kimia a, Madsen JR, et al. Prediktorer för ventrikulär shuntinfektion bland barn som presenterar en akutmottagning för barn. Pediatr Emerg Vård. 2012;28:405-409.
9. Ratilal BO, Costa J, Sampaio C. antibiotikaprofylax för kirurgisk introduktion av intrakraniella ventrikulära shuntar. Cochrane Database Syst Rev. 2006; (3): CD005365.
10. Shuntsystem. Hydrocephalus Association. www.hydroassoc.org/hydrocephalus-education-and-support/learning-about-hydrocephalus/shunts. åtkomst 12 februari 2014.
11. Framåt KR, färre HD, Stiver HG. Cerebrospinalvätska shuntinfektion. En översyn av 35 infektioner hos 32 patienter. J Neurosurg. 1983;59:389-394.
12. Det finns många olika typer av produkter. Tidig diagnos av ventrikuloperitoneala shuntinfektioner och funktionsfel hos barn med hydrocephalus. J Microbiol Immunol Infektera. 2003;36:47-50.
13. Vi är ett av de största företagen i världen. Ett standardiserat protokoll för att minska cerebrospinalvätska shuntinfektion: Hydrocephalus Clinical Research Network Quality Improvement Initiative. J Neurosurg Pediatric. 2011;8:22-29.
14. Shah SS, Sinkowitz-Cochran RL, Keyserling HL, et al. Vancomycin användning hos pediatriska neurokirurgiska patienter. Am J Infektera Kontroll. 1999;27:482-487.
15. Bratzler DW, Dellinger EP, Olsen KM, et al. Riktlinjer för klinisk praxis för antimikrobiell profylax vid operation. Am J Hälsa-Syst Pharm. 2013;70:195-283.
16. Han är en av de mest kända. Cerebrospinal shuntinfektion hos patienter som får antibiotikaimpregnerade kontra standard shunts. J Neurosurg Pediatric. 2011;8:259-265.
17. Attenello F, Garces-Ambrossi G, Zaidi H, et al. Sjukhuskostnader i samband med shuntinfektioner hos patienter som får antibiotikaimpregnerade shuntkatetrar kontra standard shuntkatetrar. Neurokirurgi. 2010;66:284-289.
18. Det är en av de mest populära. Effekt av antibiotikaimpregnerade shuntkatetrar för att minska förekomsten av shuntinfektion vid behandling av hydrocephalus. J Neurosurg. 2005; 103 (suppl): 131-136.
19. Babu MA, Patel R, Marsh WR, et al. Strategier för att minska risken för ventrikulära kateterinfektioner: en översyn av bevisen. Neurocrit Vård. 2012;16:194-202.
20. Bratzler DW, Dellinger EP, Olsen KM, et al. Riktlinjer för klinisk praxis för antimikrobiell profylax vid operation. Surg Infektera (Larchmt). 2013;14:73-156.
21. Yilmaz A, Dalgic N, Musluman M, et al. Linezolid behandling av shuntrelaterade cerebrospinalvätskeinfektioner hos barn. J Neurosurg Pediatric. 2010;5:443-448.
22. Han är en av de mest kända. Öva riktlinjer för hantering av bakteriell meningit. Clin Infektera Dis. 2004;39:1267-1284.
23. Van De Beek D, Drake JM, Tunkel AR. Nosokomial bakteriell meningit. N Engl J Med. 2010;362:146-154.
24. Hedberg A, Hardemark HG, Olsson-Liljequist B, et al. Penetration av fusidinsyra och rifampicin i cerebrospinalvätska i låggradig inflammatorisk meningit orsakad av Staphylococcus epidermidis. Clin Microbiol Infektera. 2004;10:765-768.
25. Antimikrobiell profylax för operation. Behandla Guidel Med Lett. 2004;2:27-32.
26. Simon TD, Hall M, Dean JM, et al. Reinfektion efter initial cerebrospinalvätska shuntinfektion. J Neurosurg Pediatric. 2010;6:277-285.
27. Det är en av de mest populära. Svampinfektion i en ventrikuloperitoneal shunt: histoplasmosis diagnos och behandling. World Neurosurg. 2013;80:222.e5-e13.
28. Chiou CC, Wong TT, Lin HH, et al. Svampinfektion av ventrikuloperitoneala shuntar hos barn. Clin Infektera Dis. 1994;19:1049-1053.