US Pharm. 2014; 39(4):HS2-HS7.
ABSTRACT: La gestione dell’idrocefalo, l’accumulo di liquido cerebrospinale (CSF) nei ventricoli del cervello, spesso include l’impianto di shunt per prevenire effetti a lungo termine. Gli shunt sono dispositivi di drenaggio progettati per sostenere la pressione intracranica e prevenire un ulteriore accumulo di liquido cerebrospinale, ma possono introdurre agenti patogeni nel sistema nervoso centrale. Questo può portare a infezioni e sequele, come convulsioni, fallimento dello shunt, meningite, sepsi ed encefalite. Le infezioni possono essere prevenute utilizzando tecniche asettiche, chemioprofilassi e / o shunt a eluizione antibiotica. Il trattamento di un’infezione da shunt può includere la rimozione dell’hardware infetto, il posizionamento di un dispositivo di drenaggio e l’uso di antibiotici IV o intraventricolari.
L’idrocefalo è una condizione caratterizzata da accumulo di liquido cerebrospinale (CSF) nei ventricoli o nello spazio subaracnoideo nel cervello, che porta ad un aumento della pressione intraventricolare e della dilatazione ventricolare. Un’eziologia comune dell’idrocefalo è la compromissione del drenaggio del liquido cerebrospinale.1,2 L’insorgenza di idrocefalo negli Stati Uniti e in Europa è stata stimata tra 0,5 e 0,8 per 1.000 nascite ed è spesso secondaria a spina bifida, emorragia intracranica o eziologia congenita.1,3 Altre potenziali cause di idrocefalo includono mielodisplasia, tumori, meningite, cisti fossa posteriore, malformazione Dandy-Walker, o stenosi acquedottale.4
Lo smistamento meccanico è il trattamento primario per l’idrocefalo. I posizionamenti di shunt correlati all’idrocefalo sono la procedura neurochirurgica più comune eseguita nei bambini, ma hanno anche il più alto tasso di fallimento.5 Oltre 40.000 tirocini di shunt vengono eseguiti ogni anno negli Stati Uniti, con un tasso di mortalità ospedaliera stimato del 2,7%.5,6 L’introduzione della flora cutanea comune e di altri agenti patogeni, sia perioperatorio che postoperatorio, può portare a infezioni da shunt e causare il fallimento dello shunt.
Il tasso di infezioni da shunt è stimato tra l ‘ 1,6% e il 16,7% nei pazienti adulti, ma fino al 20% nei pazienti pediatrici.2,7 Si ritiene che questo aumento nella popolazione pediatrica sia dovuto alla mancanza di immunità (in particolare <1 anno di età), alla prematurità (<35 settimane di età gestazionale), all’esposizione a potenziali agenti patogeni, alle morbilità concomitanti e ad altri fattori fisiologici.3,4 Pazienti pediatrici tendono a sviluppare infezioni shunt prima degli adulti, con la maggior parte delle infezioni che si verificano entro i primi 30 a 60 giorni dopo il posizionamento.1
I pazienti di età <5 anni e gli adulti di età compresa tra 50 e 59 anni sembrano avere la maggiore incidenza di infezioni da shunt.1 I fattori di rischio per l’infezione da shunt possono includere età più giovane, perdita postoperatoria di CSF, emorragia intraventricolare, shunt multipli, chirurgia di revisione dello shunt negli ultimi 90 giorni, shunt posizionati immediatamente dopo la meningite, degenza ospedaliera prolungata (>1 mese) e precedente infezione da shunt.2,4,7,8 Le complicanze correlate alle infezioni da shunt includono malfunzionamenti dello shunt, compromissione cognitiva a breve o lungo termine, sepsi, meningite e degenza ospedaliera prolungata.1,4,8
Tipi di shunt
I tipi più comuni di shunt sono riassunti nella TABELLA 1. Questo articolo si concentrerà sui due shunt più utilizzati: ventricoloperitoneale (VP) e ventricoloatriale (VA) shunt. Gli shunt VP, il più comune dei due, funzionano deviando il CSF al peritoneo, mentre gli shunt VA spostano il CSF nell’atrio del cuore.2,9,10

Patogenesi delle infezioni da shunt
La contaminazione da shunt è spesso causata quando l’estremità prossimale dello shunt entra in contatto con la normale flora cutanea. Ciò può verificarsi dopo l’intervento a causa di un’infezione della ferita o perioperativamente durante l’impianto chirurgico.I batteri gram-positivi 11, come Staphylococcus epidermidis coagulasi-negativo e Staphylococcus aureus, sono responsabili rispettivamente di 45% a 60% 1-3,12 e 20% a 33% 2,3 (con un rapporto fino a 80% 4) di infezioni da shunt. Questi agenti patogeni sono strettamente associati a infezioni da shunt precoci (che si verificano entro 4 settimane dall’intervento chirurgico di shunt).2
Le infezioni tardive da shunt possono verificarsi diversi mesi dopo l’intervento chirurgico di shunt e rappresentano circa il 15% delle infezioni correlate allo shunt.3 In molti casi, queste infezioni tardive possono essere causate da batteri gram-positivi, come le specie Streptococcus o Enterococcus, o batteri gram-negativi, più comunemente Pseudomonas aeruginosa, se il paziente ha avuto una perforazione intestinale o una peritonite (osservata principalmente negli shunt VP).2 I patogeni più comuni associati alle infezioni da shunt sono riassunti nella TABELLA 2.1-4,11 Le infezioni aumentano la probabilità di complicanze e fallimenti correlati allo shunt.

Prevenzione delle infezioni da shunt
I metodi impiegati per prevenire un’infezione da shunt includono l’uso di tecniche sterili, antibiotici sistemici e cateteri impregnati di antibiotici. È stato dimostrato che la tecnica chirurgica asettica aiuta a ridurre il rischio di infezioni da shunt. Un protocollo chirurgico standardizzato, incluso il lavaggio preoperatorio dei capelli del paziente con shampoo alla clorexidina, il doppio guanto da parte di tutti i membri del team chirurgico e l’uso di shunt impregnati di antibiotici (AIS), implementato da quattro ospedali per bambini, ha dimostrato un tasso di riduzione dell’infezione dall ‘ 8,8% al 5,7%.13
Gli antibiotici profilattici sistemici possono essere utilizzati durante la procedura e nelle 24 ore iniziali dopo il posizionamento dello shunt. Secondo una meta-analisi, l’uso di antibiotici sistemici, profilattici e cateteri impregnati di antibiotici ha ridotto il tasso di infezioni da shunt.9 Questo stesso studio ha confrontato l’uso di antibiotici sistemici e profilattici rispetto al placebo per la riduzione dell’infezione da shunt e ha rilevato che gli antibiotici hanno ridotto i tassi di infezioni da shunt (odds ratio , 0.52).9 Mentre l’antibiotico profilattico più appropriato per il posizionamento dello shunt non era ben definito in passato, la maggior parte dei medici usa IV cefazolina o vancomicina per la profilassi chirurgica.2,14 Recenti linee guida raccomandano cefazolina per le procedure neurochirurgiche fluido-shunting, con clindamicina e vancomicina come alternative per i pazienti allergici.15
I cateteri AIS sono stati comunemente usati per prevenire le infezioni da shunt sin dalla loro introduzione nel 2002.16 La maggior parte dei dispositivi sono impregnati con una combinazione di rifampicina e clindamicina.4,16,17 Sono progettati per indirizzare la colonizzazione di batteri gram-positivi che producono un biofilm di glicoproteina che aderisce alla superficie del catetere.16 Una meta-analisi ha esaminato l’uso di cateteri impregnati di antibiotici rispetto ai cateteri standard e ha scoperto che l’uso di cateteri impregnati di antibiotici era associato a tassi ridotti di infezione da shunt (O, 0.21). In questa meta-analisi è stato concluso che l’uso sia di profilassi antibiotica sistemica che di cateteri impregnati di antibiotici potrebbe essere utile nella riduzione delle infezioni da shunt.9
Uno studio retrospettivo è stato condotto anche in pazienti pediatrici che avevano subito l’inserimento dello shunt durante un periodo di tempo di 3 anni. Per i primi 18 mesi, i pazienti hanno ricevuto cateteri impregnati di antibiotici; per i successivi 18 mesi, qualsiasi nuovo paziente che richiedesse il posizionamento dello shunt ha ricevuto cateteri impregnati di antibiotici. Tutti i bambini sono stati seguiti per 6 mesi dopo il posizionamento dello shunt. I bambini con cateteri impregnati nonantibiotici avevano un tasso di infezione del 12%, mentre l’infezione è stata osservata solo nell ‘ 1,4% dei bambini con cateteri impregnati di antibiotici.18 Una revisione più recente di 15 studi ha anche concluso che i cateteri rivestiti con antibiotici riducono il tasso di infezione clinica, in particolare nei pazienti con cateteri a lungo termine, il che era diverso da alcune analisi precedenti.19
Prevenire le infezioni da shunt attraverso la profilassi e l’uso di cateteri AIS ha dimostrato di ridurre i costi di cura del paziente.20 Si stima che il costo per il trattamento di un’infezione da shunt possa variare da $17.300 a patient 48.454 per paziente, portando a un costo ospedaliero annuale stimato negli Stati Uniti di billion 2 miliardi.16,17 Sebbene ogni catetere AIS costa in media $400, la quantità di denaro risparmiata prevenendo l’infezione e/o la reinfezione può fornire significativi risparmi a lungo termine.16 Questi risparmi sono dovuti a una probabilità di infezione diminuita di 2,4 volte e alla diminuzione del tempo in ospedale a causa dell’infezione. È stato riferito che questi risparmi ammonterebbero a oltre $440.000 per 100 pazienti deviati.17
Diagnosi di infezioni da shunt
Infezione da shunt generale I sintomi includono mal di testa, nausea, vomito, infiammazione del sito chirurgico, anomalie neurologiche, febbre e convulsioni.2,3 Le manifestazioni cliniche specifiche del paziente delle infezioni da shunt dipendono dal tipo di shunt impiantato. Gli shunt VP possono essere associati a peritonite, anoressia, irritabilità e dolore addominale,8 mentre gli shunt VA possono essere associati a sepsi ed endocardite.2,3 Se si osservano manifestazioni cliniche come stato mentale alterato, eritema che circonda il sito dello shunt, fluido lungo la pista dello shunt, secrezione purulenta, papilledema, fontanella sporgente, rigidità nucale o evidente perdita di liquido cerebrospinale, il paziente deve essere valutato con analisi del liquido cerebrospinale, emocolture e imaging cerebrale.8
L ‘analisi predittiva del CSF per l’ infezione comprende un aumento della conta dei globuli bianchi, un aumento delle concentrazioni proteiche e una diminuzione dei livelli di glucosio; il CSF deve anche essere coltivato e macchiato di gram. Le emocolture sono indicatori più utili di infezioni da shunt VA rispetto alle infezioni da shunt VP.11 L’imaging cerebrale può essere utilizzato per identificare la ventricolite o la prova di ostruzione del CSF. L’imaging addominale può anche essere utilizzato per identificare il malfunzionamento dello shunt VP.
Opzioni di trattamento
Attualmente, non ci sono linee guida pratiche per il trattamento delle infezioni da shunt; tuttavia, la rimozione dell’hardware infetto, il posizionamento di un drenaggio ventricolare esterno, le colture e il trattamento con anti-biotici IV o intraventricolari sono tutti mostrati come parte di un efficace processo di gestione.2
Le attuali raccomandazioni per il trattamento empirico dell’infezione del sistema nervoso centrale (SNC) in presenza di uno shunt raccomandano l’uso di IV vancomicina in combinazione con un agente che ha un’adeguata copertura gram-negativa, come cefepime, ceftazidime, cefotaxime o meropenem. La capacità di un farmaco di penetrare nel liquido cerebrospinale e l’attività dell’antibiotico contro il biofilm batterico sono anche importanti da considerare per la scelta degli antibiotici.21 Tali agenti devono essere somministrati fino all’identificazione dell’agente patogeno e alla determinazione del trattamento definitivo.22,23 In uno shunt VP, la punta distale dello shunt si trova all’interno della cavità peritoneale ed è più suscettibile ai batteri gram-negativi; la gentamicina può essere aggiunta per sinergia.2 La terapia antimicrobica empirica e le raccomandazioni di dosaggio per le infezioni dello shunt sono riassunte nella TABELLA 3.2,18,22,23
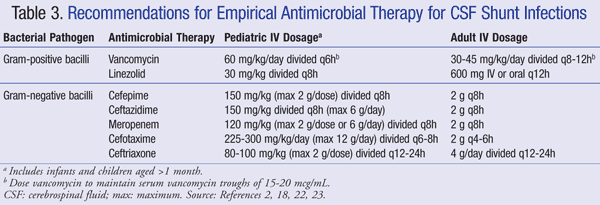
Per i pazienti refrattari alla terapia con vancomicina, linezolid 10 mg/kg ogni 8 ore si è dimostrato efficace in monoterapia nei pazienti pediatrici.21 L’aggiunta di rifampicina come terapia aggiuntiva può anche essere considerata a causa della sua penetrazione nel SNC.24 La durata della terapia antibiotica dipende in gran parte dall’approccio chirurgico utilizzato, dal tipo di shunt e dall’agente patogeno coinvolto, con uno studio che riporta una durata della terapia da 4 a 47 giorni.25,26 Più specificamente, 7 a 10 giorni è stato suggerito per la durata del trattamento, 23 con un corso più lungo (10-14 giorni) raccomandato per le infezioni gram-negative.2
Nel caso di infezioni da shunt complicate o resistenti al trattamento, i medici devono considerare la somministrazione intratecale o intraventricolare di antibiotici per una maggiore efficacia a causa della loro capacità di raggiungere concentrazioni battericide più elevate all’interno del SNC.23 Vancomicina e gentamicina sono comunemente usati in questa situazione; tuttavia, non ci sono raccomandazioni definitive sul loro uso.22,23
Infezioni da shunt fungini
Un’infezione da shunt fungino è considerata rara, con uno studio che riporta un tasso di incidenza dello 0,01%.27 I patogeni più comuni responsabili di un’infezione da shunt fungino sono le specie di Candida (tra cui C albicans, C parapsilosis e C tropicalis), che causano il 75% dei casi di funghi. Altri organismi includono specie di istoplasmosi, Cryptococcus neoformans e specie di Aspergillus. Il trattamento primario per le infezioni fungine dello shunt è l’amfotericina liposomiale B da 3 a 5 mg / kg / die per almeno 12 settimane.27 Per i pazienti intolleranti ad amfotericina B, la 5-flucitosina può essere un’alternativa.28 Questo è spesso seguito da un trattamento con fluconazolo da 600 a 800 mg / die o itraconazolo 200 mg due o tre volte al giorno per un massimo di 1 anno in pazienti immunocompetenti e terapia potenzialmente per tutta la vita in pazienti immunocompromessi.27
Conclusione
Le infezioni da shunt sono un fattore di rischio associato al trattamento con idrocefalo. La prevenzione delle infezioni è stata dimostrata con antibiotici empirici e l’uso di cateteri AIS, combinati con una corretta tecnica asettica, per ridurre significativamente il tasso di infezione e ridurre il rischio di sequele comorbide. Non ci sono attualmente linee guida per il trattamento delle infezioni dello shunt; tuttavia, la terapia empirica IV che comprende sia la copertura gram-positiva che gram-negativa, quali vancomicina e una cefalosporina di terza generazione, sarebbe raccomandata. Gli antibiotici intraventricolari possono anche essere necessari per la massima concentrazione battericida del SNC.
1. I nostri servizi sono a vostra disposizione. Studio delle infezioni associate allo shunt del liquido cerebrospinale nel primo anno successivo al posizionamento, da parte del Canadian Nosocomial Infection Surveillance. Infect Control Hospital Epidemiol. 2009;30:285-288.
2. Wells DL, Allen JM. Infezioni dello shunt ventricoloperitoneale in pazienti adulti. AACN Adv Crit Cura. 2013;24:6-12.
3. I nostri prodotti sono disponibili in tutto il mondo. Incidenza e fattori di rischio delle infezioni da shunt ventricoloperitoneale nei bambini: uno studio su 333 shunt consecutivi in 6 anni. J coreano Med Sci. 2012;27:1563-1568.
4. Parker SL, Attenello FJ, Sciubba DM, et al. Confronto dell’incidenza di infezione da shunt in sottogruppi ad alto rischio che ricevono shunt impregnati di antibiotici rispetto agli shunt standard. Childs Nerv Syst. 2009;25:77-83.
5. Trattamento dell’idrocefalo. Associazione idrocefalo. www.hydroassoc.org / idrocefalo-educazione-e-supporto / learning-about-idrocefalo / trattamento-di-idrocefalo/. Accesso 11 febbraio 2014.
6. Patwardhan RV, Nanda A. Shunt ventricolari impiantati negli Stati Uniti: il costo di miliardi di dollari all’anno del trattamento con idrocefalo. Neurochirurgia. 2005;56:139-144.
7. Dallacasa P, Dappozzo A, Galassi E, et al. Infezioni da shunt del liquido cerebrospinale nei neonati. Childs Nerv Syst. 1995;11:643-648.
8. Il suo nome deriva dal greco antico. Predittori di infezione da shunt ventricolare tra i bambini che si presentano a un pronto soccorso pediatrico. Pediatr Emerg Cura. 2012;28:405-409.
9. Ratilal BO, Costa J, Sampaio C. Profilassi antibiotica per l’introduzione chirurgica di shunt ventricolari intracranici. Cochrane Database Syst Rev. 2006; (3): CD005365.
10. Sistemi di shunt. Associazione idrocefalo. www.hydroassoc.org/hydrocephalus-education-and-support/learning-about-hydrocephalus/shunts. Accesso 12 febbraio 2014.
11. Forward KR, Meno HD, Stiver HG. Infezione da shunt del liquido cerebrospinale. Una revisione di 35 infezioni in 32 pazienti. J Neurochirurgia. 1983;59:389-394.
12. Per maggiori informazioni:
13. Il suo nome deriva dal latino “Kestle JR”, “Riva-Cambrin J”, “Wellons JC”, et al. Un protocollo standardizzato per ridurre l’infezione da shunt del liquido cerebrospinale: l’iniziativa per il miglioramento della qualità della rete di ricerca clinica dell’idrocefalo. J Neurochirurgia Pediatr. 2011;8:22-29.
14. Shah SS, Sinkowitz-Cochran RL, Keyserling HL, et al. Uso di vancomicina in pazienti di neurochirurgia pediatrica. Am J Controllo infettare. 1999;27:482-487.
15. Bratzler DW, Dellinger EP, Olsen KM, et al. Linee guida di pratica clinica per la profilassi antimicrobica in chirurgia. Am J Salute-Syst Pharm. 2013;70:195-283.
16. Per maggiori informazioni:
17. Attenello F, Garces-Ambrossi G, Zaidi H, et al. Costi ospedalieri associati a infezioni da shunt in pazienti trattati con cateteri shunt impregnati di antibiotici rispetto ai cateteri shunt standard. Neurochirurgia. 2010;66:284-289.
18. Sciubba DM, Stuart RM, McGirt MJ, et al. Effetto dei cateteri shunt impregnati di antibiotici nel ridurre l’incidenza dell’infezione da shunt nel trattamento dell’idrocefalo. J Neurochirurgia. 2005;103 (suppl): 131-136.
19. I nostri servizi Strategie per ridurre il rischio di infezioni da catetere ventricolare: una revisione delle prove. Cura Neurocrit. 2012;16:194-202.
20. Bratzler DW, Dellinger EP, Olsen KM, et al. Linee guida di pratica clinica per la profilassi antimicrobica in chirurgia. Surg Infettare (larice). 2013;14:73-156.
21. Yilmaz A, Dalgic N, Musluman M, et al. Linezolid trattamento delle infezioni del liquido cerebrospinale correlate allo shunt nei bambini. J Neurochirurgia Pediatr. 2010;5:443-448.
22. I nostri servizi sono a vostra disposizione. Linee guida pratiche per la gestione della meningite batterica. Clin Infettare Dis. 2004;39:1267-1284.
23. Van de Beek D, Drake JM, Tunkel AR. Meningite batterica nosocomiale. N Ingl J Med. 2010;362:146-154.
24. HG, Olsson-Liljequist B, et al. Penetrazione di acido fusidico e rifampicina nel liquido cerebrospinale nella meningite infiammatoria di basso grado causata da Staphylococcus epidermidis. Clin Microbiol Infettare. 2004;10:765-768.
25. Profilassi antimicrobica per la chirurgia. Trattare Guidel Med Lett. 2004;2:27-32.
26. I nostri servizi sono a vostra disposizione. Reinfezione dopo l’infezione iniziale dello shunt del liquido cerebrospinale. J Neurochirurgia Pediatr. 2010;6:277-285.
27. Il suo nome deriva dal greco antico. Infezione fungosa di uno shunt ventricoloperitoneal: istoplasmosis la diagnosi e il trattamento. Neurochirurgia mondiale. 2013;80:222.e5-e13.
28. Chiou CC, Wong TT, Lin HH, et al. Infezione fungina degli shunt ventricoloperitoneali nei bambini. Clin Infettare Dis. 1994;19:1049-1053.