US Pharm. 2014;39(4):HS2-HS7.
ZUSAMMENFASSUNG: Die Behandlung des Hydrocephalus, der Ansammlung von Liquor cerebrospinalis (CSF) in den Ventrikeln des Gehirns, umfasst häufig die Shunt-Implantation, um Langzeiteffekte zu verhindern. Shunts sind Drainagevorrichtungen, die den intrakraniellen Druck aufrechterhalten und eine weitere Ansammlung von Liquor verhindern sollen, aber sie können Krankheitserreger in das zentrale Nervensystem einbringen. Dies kann zu Infektionen und Folgen wie Krampfanfällen, Shuntversagen, Meningitis, Sepsis und Enzephalitis führen. Infektionen können durch aseptische Techniken, Chemoprophylaxe und / oder Antibiotika-eluierende Shunts verhindert werden. Die Behandlung einer Shunt-Infektion kann die Entfernung der infizierten Hardware, die Platzierung einer Drainagevorrichtung und die Verwendung von IV- oder intraventrikulären Antibiotika umfassen.
Hydrocephalus ist ein Zustand, der durch Ansammlung von Liquor cerebrospinalis (CSF) in den Ventrikeln oder im Subarachnoidalraum des Gehirns gekennzeichnet ist und zu erhöhtem intraventrikulärem Druck und ventrikulärer Dilatation führt. Eine häufige Ätiologie des Hydrozephalus ist die Beeinträchtigung der Liquordrainage.1,2 Das Auftreten von Hydrocephalus in den Vereinigten Staaten und Europa wurde auf 0,5 bis 0,8 pro 1.000 Geburten geschätzt und ist häufig sekundär zu Spina bifida, intrakraniellen Blutungen oder angeborener Ätiologie.1,3 Andere mögliche Ursachen für Hydrocephalus sind Myelodysplasie, Tumoren, Meningitis, hintere Fossa-Zyste, Dandy-Walker-Fehlbildung oder Aquäduktalstenose.4
Mechanisches Rangieren ist die primäre Behandlung für Hydrocephalus. Hydrocephalus-bezogene Shunt-Platzierungen sind die häufigsten neurochirurgischen Verfahren bei Kindern durchgeführt, aber sie haben auch die höchste Ausfallrate.5 In den USA werden jährlich über 40.000 Shunt-Platzierungen mit einer geschätzten stationären Sterblichkeitsrate von 2,7% durchgeführt.5,6 Die Einführung einer gemeinsamen Hautflora und anderer Krankheitserreger, sowohl perioperativ als auch postoperativ, kann zu Shunt-Infektionen und zu Shunt-Versagen führen.
Die Rate der Shunt-Infektionen wird bei erwachsenen Patienten auf 1,6% bis 16,7%, bei pädiatrischen Patienten auf bis zu 20% geschätzt.2,7 Es wird angenommen, dass dieses erhöhte Auftreten in der pädiatrischen Population auf mangelnde Immunität (insbesondere < 1 Jahr), Frühgeburtlichkeit (< 35 Schwangerschaftswochen), Exposition gegenüber potenziellen Krankheitserregern, Begleiterkrankungen und andere physiologische Faktoren zurückzuführen ist.3,4 Pädiatrische Patienten neigen dazu, Shunt-Infektionen früher als Erwachsene zu entwickeln, wobei die meisten Infektionen innerhalb der ersten 30 bis 60 Tage nach der Platzierung auftreten.1
Patienten im Alter von < 5 Jahren und Erwachsene im Alter von 50 bis 59 Jahren scheinen die größte Inzidenz von Shunt-Infektionen zu haben.1 Risikofaktoren für eine Shuntinfektion können jüngeres Alter, postoperatives Liquorleck, intraventrikuläre Blutung, mehrere Shunts, Shunt-Revisionsoperationen in den letzten 90 Tagen, Shunts unmittelbar nach der Meningitis, längerer Krankenhausaufenthalt (> 1 Monat) und vorherige Shuntinfektion sein.2,4,7,8 Komplikationen im Zusammenhang mit Shunt-Infektionen umfassen Shunt-Fehlfunktionen, kurz- oder langfristige kognitive Beeinträchtigungen, Sepsis, Meningitis und verlängerte Krankenhausaufenthalte.1,4,8
Shunt-Typen
Die häufigsten Shunt-Typen sind in TABELLE 1 zusammengefasst. Dieser Artikel konzentriert sich auf die beiden am häufigsten verwendeten Shunts: ventrikuloperitoneale (VP) und ventrikuloatriale (VA) Shunts. VP-Shunts, die häufigere der beiden, arbeiten, indem sie den Liquor zum Peritoneum umleiten, während VA-Shunts den LIQUOR zum Atrium des Herzens verlagern.2,9,10

Pathogenese von Shunt-Infektionen
Eine Shunt-Kontamination wird häufig verursacht, wenn das proximale Ende des Shunts mit der normalen Hautflora in Kontakt kommt. Dies kann postoperativ aufgrund einer Wundinfektion oder perioperativ während der chirurgischen Implantation auftreten.11 Grampositive Bakterien, wie Koagulase-negative Staphylococcus epidermidis und Staphylococcus aureus, sind für 45% bis 60% verantwortlich 1-3,12 und 20% bis 33%2,3 (mit einem Bericht bis zu 80%4) von Shunt-Infektionen. Diese Erreger sind eng mit frühen Shunt-Infektionen assoziiert (die innerhalb von 4 Wochen nach der Shunt-Operation auftreten).2
Späte Shunt-Infektionen können mehrere Monate nach einer Shunt-Operation auftreten und machen etwa 15% der Shunt-bedingten Infektionen aus.3 In vielen Fällen können diese späten Infektionen entweder durch grampositive Bakterien wie Streptokokken oder Enterokokken oder durch gramnegative Bakterien, am häufigsten Pseudomonas aeruginosa, verursacht werden, wenn der Patient eine Darmperforation oder Peritonitis erlitten hat (hauptsächlich bei VP-Shunts).2 Die häufigsten mit Shunt-Infektionen assoziierten Erreger sind in TABELLE 2.1-4,11 zusammengefasst Infektionen erhöhen die Wahrscheinlichkeit von Shunt-bedingten Komplikationen und Ausfällen.

Prävention von Shuntinfektionen
Methoden zur Verhinderung einer Shuntinfektion umfassen die Verwendung steriler Techniken, systemischer Antibiotika und mit Antibiotika imprägnierter Katheter. Es wurde gezeigt, dass eine aseptische Operationstechnik dazu beiträgt, das Risiko von Shunt-Infektionen zu verringern. Ein standardisiertes Operationsprotokoll, das das präoperative Waschen der Haare des Patienten mit Chlorhexidin-Shampoo, das doppelte Behandeln aller Mitglieder des Operationsteams und die Verwendung von Antibiotika-imprägnierten Shunts (AIS) umfasste, das von vier Kinderkrankenhäusern durchgeführt wurde, zeigte eine Infektionsreduktionsrate von 8,8% auf 5,7%.13
Systemische prophylaktische Antibiotika können während des Eingriffs und in den ersten 24 Stunden nach der Shuntplatzierung verwendet werden. Laut einer Metaanalyse reduzierte der Einsatz systemischer, prophylaktischer Antibiotika und mit Antibiotika imprägnierter Katheter die Rate der Shunt-Infektionen.9 Dieselbe Studie verglich die Verwendung systemischer, prophylaktischer Antibiotika mit Placebo zur Verringerung der Shunt-Infektion und stellte fest, dass die Antibiotika die Rate der Shunt-Infektionen verringerten (Odds Ratio, 0,52).9 Während das am besten geeignete prophylaktische Antibiotikum für die Shunt-Platzierung in der Vergangenheit nicht gut definiert war, verwenden die meisten Kliniker IV Cefazolin oder Vancomycin zur chirurgischen Prophylaxe.2,14 Jüngste Leitlinien empfehlen Cefazolin für neurochirurgische Fluid-Shunt-Verfahren mit Clindamycin und Vancomycin als Alternativen für allergische Patienten.15
AIS-Katheter werden seit ihrer Einführung im Jahr 2002 häufig zur Vorbeugung von Shunt-Infektionen eingesetzt.16 Die meisten Geräte sind mit einer Kombination aus Rifampicin und Clindamycin imprägniert.4,16,17 Sie zielen auf die Besiedlung von grampositiven Bakterien ab, die einen Glykoprotein-Biofilm produzieren, der an der Katheteroberfläche haftet.16 Eine Metaanalyse untersuchte die Verwendung von Antibiotika-imprägnierten Kathetern im Vergleich zu Standardkathetern und ergab, dass die Verwendung von Antibiotika-imprägnierten Kathetern mit verringerten Shunt-Infektionsraten verbunden war (OR, 0,21). In dieser Metaanalyse wurde der Schluss gezogen, dass die Verwendung sowohl der systemischen Antibiotikaprophylaxe als auch der mit Antibiotika imprägnierten Katheter bei der Verringerung von Shunt-Infektionen von Vorteil sein könnte.9
Eine retrospektive Studie wurde auch bei pädiatrischen Patienten durchgeführt, die sich während eines Zeitraums von 3 Jahren einer Shunt-Insertion unterzogen hatten. In den ersten 18 Monaten erhielten die Patienten nichtantibiotisch imprägnierte Katheter; In den nächsten 18 Monaten erhielt jeder neue Patient, der eine Shunt-Platzierung benötigte, antibiotisch imprägnierte Katheter. Alle Kinder wurden 6 Monate nach der Shunt-Platzierung beobachtet. Die Kinder mit nicht antibiotisch imprägnierten Kathetern hatten eine Infektionsrate von 12%, während die Infektion nur bei 1,4% der Kinder mit antibiotisch imprägnierten Kathetern auftrat.18 Eine neuere Überprüfung von 15 Studien kam auch zu dem Schluss, dass Antibiotika-beschichtete Katheter die klinische Infektionsrate verringern, insbesondere bei Patienten mit Langzeitkathetern, was sich von einigen früheren Analysen unterschied.19
Es wurde gezeigt, dass die Prävention von Shunt-Infektionen durch Prophylaxe und die Verwendung von AIS-Kathetern die Kosten für die Patientenversorgung senkt.20 Es wird geschätzt, dass die Kosten für die Behandlung einer Shunt-Infektion zwischen 17.300 und 48.454 US-Dollar pro Patient liegen können, was zu geschätzten jährlichen Krankenhauskosten in den USA von 2 Milliarden US-Dollar führt.16,17 Obwohl jeder AIS-Katheter durchschnittlich 400 US-Dollar kostet, kann der Geldbetrag, der durch die Verhinderung einer Infektion und / oder einer erneuten Infektion eingespart wird, erhebliche langfristige Einsparungen ermöglichen.16 Diese Einsparungen sind auf eine um das 2,4-fache verringerte Wahrscheinlichkeit einer Infektion und eine verkürzte Zeit im Krankenhaus infolge einer Infektion zurückzuführen. Es wurde berichtet, dass sich diese Einsparungen auf über 440.000 US-Dollar pro 100 Patienten belaufen würden.17
Diagnose von Shuntinfektionen
Zu den allgemeinen Symptomen einer Shuntinfektion gehören Kopfschmerzen, Übelkeit, Erbrechen, Entzündungen der Operationsstelle, neurologische Anomalien, Fieber und Krampfanfälle.2,3 Patientenspezifische klinische Manifestationen von Shunt-Infektionen hängen von der Art des implantierten Shunts ab. VP-Shunts können mit Peritonitis, Anorexie, Reizbarkeit und Bauchschmerzen in Verbindung gebracht werden8, während VA-Shunts mit Sepsis und Endokarditis in Verbindung gebracht werden können.2,3 Wenn klinische Manifestationen wie ein veränderter mentaler Status, ein Erythem um die Shunt-Stelle, Flüssigkeit entlang der Shunt-Spur, eitriger Ausfluss, Papillenödem, prall gefüllte Fontanelle, Nackensteifigkeit oder offensichtliche Liquorlecks auftreten, sollte der Patient mit einer Liquoranalyse, Blutkulturen und einer zerebralen Bildgebung untersucht werden.8
Die Liquoranalyse, die eine Infektion voraussagt, umfasst eine erhöhte Anzahl weißer Blutkörperchen, erhöhte Proteinkonzentrationen und verringerte Glukosespiegel; Der Liquor sollte auch kultiviert und gramgefärbt werden. Blutkulturen sind nützlichere Indikatoren für VA-Shunt-Infektionen im Gegensatz zu VP-Shunt-Infektionen.11 Die zerebrale Bildgebung kann verwendet werden, um Ventrikulitis oder Anzeichen einer Liquorobstruktion zu identifizieren. Die abdominale Bildgebung kann auch verwendet werden, um eine VP-Shunt-Fehlfunktion zu identifizieren.
Behandlungsmöglichkeiten
Derzeit gibt es keine Praxisrichtlinien für die Behandlung von Shunt-Infektionen; Es wird jedoch gezeigt, dass die Entfernung der infizierten Hardware, die Platzierung eines externen ventrikulären Drains, Kulturen und die Behandlung mit IV oder intraventrikulären Antibiotika Teil eines effektiven Managementprozesses sind.2
Aktuelle Empfehlungen für die empirische Behandlung von Infektionen des Zentralnervensystems (ZNS) in Gegenwart eines Shunts empfehlen die Verwendung von IV Vancomycin in Kombination mit einem Mittel, das eine ausreichende gramnegative Abdeckung aufweist, wie Cefepim, Ceftazidim, Cefotaxim oder Meropenem. Die Fähigkeit eines Medikaments, in den Liquor einzudringen, sowie die Aktivität des Antibiotikums gegen den bakteriellen Biofilm sind ebenfalls wichtig für die Wahl des Antibiotikums.21 Solche Mittel sollten verabreicht werden, bis der Erreger identifiziert und die endgültige Behandlung festgelegt ist.22,23 Bei einem VP-Shunt liegt die distale Spitze des Shunts in der Bauchhöhle und ist anfälliger für gramnegative Bakterien; Gentamicin kann zur Synergie hinzugefügt werden.2 Empirische antimikrobielle Therapie- und Dosierungsempfehlungen für Shunt-Infektionen sind in der TABELLE zusammengefasst 3.2,18,22,23
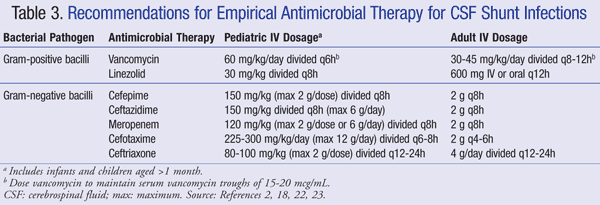
Bei Patienten, die auf eine Vancomycin-Therapie nicht ansprechen, hat sich Linezolid 10 mg / kg alle 8 Stunden als Monotherapie bei pädiatrischen Patienten als wirksam erwiesen.21 Die Zugabe von Rifampicin als Zusatztherapie kann auch aufgrund seiner Penetration in das ZNS in Betracht gezogen werden.24 Die Dauer der Antibiotikatherapie hängt weitgehend vom verwendeten chirurgischen Ansatz, der Art des Shunts und dem beteiligten Erreger ab, wobei eine Studie von einer Therapiedauer von 4 bis 47 Tagen berichtete.25,26 Insbesondere wurden 7 bis 10 Tage für die Behandlungsdauer vorgeschlagen,23 mit einem längeren Verlauf (10-14 Tage) für gramnegative Infektionen empfohlen.2
Bei komplizierten oder behandlungsresistenten Shunt-Infektionen sollten Kliniker die intrathekale oder intraventrikuläre Verabreichung von Antibiotika in Betracht ziehen, um die Wirksamkeit zu erhöhen, da sie höhere bakterizide Konzentrationen im ZNS erreichen können.23 Vancomycin und Gentamicin werden in dieser Situation häufig verwendet; Es gibt jedoch keine endgültigen Empfehlungen zu ihrer Verwendung.22,23
Pilz-Shunt-Infektionen
Eine Pilz-Shunt-Infektion gilt als selten, wobei eine Studie eine Inzidenzrate von 0,01% meldete.27 Die häufigsten Erreger, die für eine Pilz-Shunt-Infektion verantwortlich sind, sind Candida-Arten (einschließlich C albicans, C parapsilosis und C tropicalis), die 75% der Pilzfälle verursachen. Andere Organismen umfassen Histoplasmose-Arten, Cryptococcus neoformans und Aspergillus-Arten. Die primäre Behandlung von Pilz-Shunt-Infektionen ist liposomales Amphotericin B 3 bis 5 mg / kg / Tag für mindestens 12 Wochen.27 Für Patienten, die Amphotericin B nicht vertragen, kann 5-Flucytosin eine Alternative sein.28 Bei immunkompetenten Patienten folgt häufig eine Behandlung mit Fluconazol 600 bis 800 mg / Tag oder Itraconazol 200 mg zwei- bis dreimal täglich für bis zu 1 Jahr und möglicherweise eine lebenslange Therapie bei immungeschwächten Patienten.27
Schlussfolgerung
Shunt-Infektionen sind ein Risikofaktor im Zusammenhang mit der Behandlung von Hydrocephalus. Die Infektionsprävention wurde mit empirischen Antibiotika und der Verwendung von AIS-Kathetern in Kombination mit einer geeigneten aseptischen Technik nachgewiesen, um die Infektionsrate signifikant zu senken und das Risiko komorbider Folgen zu verringern. Es gibt derzeit keine Richtlinien für die Behandlung von Shunt-Infektionen; jedoch, IV empirische Therapie mit grampositiven und gramnegativen Antibiotika, wie Vancomycin und ein Cephalosporin der dritten Generation, würde empfohlen werden. Intraventrikuläre Antibiotika können auch für eine maximale bakterizide ZNS-Konzentration erforderlich sein.
1. Langley JM, Gravel D, Moore D, et al. Studie von Cerebrospinalflüssigkeit Shunt-assoziierte Infektionen im ersten Jahr nach der Platzierung durch die kanadische nosokomiale Infektionsüberwachung. Infizieren Kontrolle Krankenhaus Epidemiol. 2009;30:285-288.
2. Wells DL, Allen JM. Ventrikuloperitoneale Shunt-Infektionen bei erwachsenen Patienten. AACN Adv Crit Pflege. 2013;24:6-12.
3. Lee JK, Seok JY, Lee JH, et al. Inzidenz und Risikofaktoren von ventrikuloperitonealen Shuntinfektionen bei Kindern: Eine Studie mit 333 aufeinanderfolgenden Shunts in 6 Jahren. In: J Korean Med Sci. 2012;27:1563-1568.
4. Parker SL, Attenello FJ, Sciubba DM, et al. Vergleich der Shunt-Infektionsinzidenz in Hochrisikountergruppen, die mit Antibiotika imprägniert wurden, mit Standard-Shunts. In: Childs Nerv Syst. 2009;25:77-83.
5. Behandlung von Hydrocephalus. In: Hydrocephalus Association. www.in: hydroassoc.org/hydrocephalus-Bildung-und-Unterstützung/Lernen-über-Hydrocephalus /Behandlung-von-Hydrocephalus /. Zugriff am 11.Februar 2014.
6. Patwardhan RV, Nanda A. Implantierte ventrikuläre Shunts in den Vereinigten Staaten: die Milliarden-Dollar-pro-Jahr-Kosten der Hydrocephalus-Behandlung. Neurochirurgie. 2005;56:139-144.
7. Dallacasa P, Dappozzo A, Galassi E, et al. Cerebrospinalflüssigkeit Shunt-Infektionen bei Säuglingen. In: Childs Nerv Syst. 1995;11:643-648.
8. Rogers EA, Kimia A, Madsen JR., et al. Prädiktoren für eine ventrikuläre Shunt-Infektion bei Kindern, die sich in einer pädiatrischen Notaufnahme präsentieren. In: Pediatr Emerg Care. 2012;28:405-409.
9. Ratilal BO, Costa J, Sampaio C. Antibiotikaprophylaxe zur chirurgischen Einführung intrakranieller ventrikulärer Shunts. Cochrane Database Syst Rev. 2006;(3):CD005365.
10. Shunt-Systeme. In: Hydrocephalus Association. www.hydroassoc.org/hydrocephalus-education-and-support/learning-about-hydrocephalus/shunts . Zugriff Februar 12, 2014.
11. Vorwärts KR, Weniger HD, Stiver HG. Zerebrospinalflüssigkeit Shunt-Infektion. Eine Überprüfung von 35 Infektionen bei 32 Patienten. J Neurochirurg. 1983;59:389-394.
12. Wong TT, Chen SJ, et al. Früherkennung von ventrikuloperitonealen Shunt-Infektionen und Fehlfunktionen bei Kindern mit Hydrozephalus. J Microbiol Immunol infizieren. 2003;36:47-50.
13. Kestle JR, Riva-Cambrin J, Wellons JC, et al. Ein standardisiertes Protokoll zur Verringerung der Liquor-Shunt-Infektion: die Qualitätsverbesserungsinitiative des Hydrocephalus Clinical Research Network. In: J Neurosurgery Pediatr. 2011;8:22-29.
14. Schah SS, Sinkowitz-Cochran RL, Keyserling HL, et al. Vancomycin Verwendung bei pädiatrischen Neurochirurgie Patienten. Am J infizieren Kontrolle. 1999;27:482-487.
15. Bratzler DW, Dellinger EP, Olsen KM, et al. Leitlinien für die klinische Praxis zur antimikrobiellen Prophylaxe in der Chirurgie. In: Am J Health-Syst Pharm. 2013;70:195-283.
16. Lilienfeld S., Anderson W.N., et al. Zerebrospinale Shunt-Infektion bei Patienten, die Antibiotika-imprägnierte versus Standard-Shunts erhalten. In: J Neurosurgery Pediatr. 2011;8:259-265.
17. Garces-Ambrossi G, Attenello F, Zaidi H, et al. Krankenhauskosten im Zusammenhang mit Shunt-Infektionen bei Patienten, die Antibiotika-imprägnierte Shunt-Katheter im Vergleich zu Standard-Shunt-Kathetern erhalten. Neurochirurgie. 2010;66:284-289.
18. Sciubba DM, Stuart RM, McGirt MJ, et al. Wirkung von Antibiotika-imprägnierten Shunt-Kathetern bei der Verringerung der Inzidenz von Shunt-Infektionen bei der Behandlung von Hydrocephalus. J Neurochirurg. 2005;103(Ergänzung): 131-136.
19. In: Babu MA, Patel R, Marsh WR, et al. Strategien zur Verringerung des Risikos von ventrikulären Katheterinfektionen: eine Überprüfung der Evidenz. In: Neurocrit Care. 2012;16:194-202.
20. Bratzler DW, Dellinger EP, Olsen KM, et al. Leitlinien für die klinische Praxis zur antimikrobiellen Prophylaxe in der Chirurgie. Surg infizieren (Larchmt). 2013;14:73-156.
21. Yilmaz A, Dalgic N, Musluman M, et al. Linezolid Behandlung von Shunt-bedingten Liquorinfektionen bei Kindern. In: J Neurosurgery Pediatr. 2010;5:443-448.
22. Tunkel AR, Hartman BJ, Kaplan SL, et al. Praxisrichtlinien für die Behandlung von bakterieller Meningitis. Clin Infizieren Dis. 2004;39:1267-1284.
23. Van de Beek D, Drake JM, Tunkel AR. Nosokomiale bakterielle Meningitis. In: N Engl J Med. 2010;362:146-154.
24. Die Ergebnisse werden veröffentlicht in: Hedberg A, Hardemark HG, Olsson-Liljequist B, et al. Eindringen von Fusidinsäure und Rifampicin in die Liquor Cerebrospinalis bei niedriggradiger entzündlicher Meningitis durch Staphylococcus epidermidis. Clin Microbiol infizieren. 2004;10:765-768.
25. Antimikrobielle Prophylaxe für die Chirurgie. Behandeln Guidel Med Lett. 2004;2:27-32.
26. Simon TD, Halle M, Dean JM, et al. Reinfektion nach initialer Liquor-Shunt-Infektion. In: J Neurosurgery Pediatr. 2010;6:277-285.
27. Veeravagu A, Ludwig C, Camara-Quintana JQ, et al. Pilzinfektion eines ventrikuloperitonealen Shunts: Histoplasmose Diagnose und Behandlung. Weltneurochirurgie. 2013;80:222.e5-e13.
28. Wong TT, Lin HH, et al. Pilzinfektion von ventrikuloperitonealen Shunts bei Kindern. Clin Infizieren Dis. 1994;19:1049-1053.