US Pharm. 2014; 39(4): HS2-HS7.
RÉSUMÉ: La prise en charge de l’hydrocéphalie, l’accumulation de liquide céphalo-rachidien (LCR) dans les ventricules du cerveau, comprend souvent une implantation de shunt pour prévenir les effets à long terme. Les shunts sont des dispositifs de drainage conçus pour maintenir la pression intracrânienne et empêcher une accumulation supplémentaire de LCR, mais ils peuvent introduire des agents pathogènes dans le système nerveux central. Cela peut entraîner des infections et des séquelles, telles que des convulsions, une défaillance du shunt, une méningite, une septicémie et une encéphalite. Les infections peuvent être prévenues en utilisant des techniques aseptiques, une chimioprophylaxie et / ou des shunts à élution antibiotique. Le traitement d’une infection par dérivation peut inclure le retrait du matériel infecté, la mise en place d’un dispositif de drainage et l’utilisation d’antibiotiques intraventriculaires ou intraventriculaires.
L’hydrocéphalie est une affection caractérisée par une accumulation de liquide céphalo-rachidien (LCR) dans les ventricules ou l’espace sous-arachnoïdien du cerveau, entraînant une augmentation de la pression intraventriculaire et une dilatation ventriculaire. Une étiologie courante de l’hydrocéphalie est une altération du drainage du LCR.1,2 La survenue d’hydrocéphalie aux États-Unis et en Europe a été estimée à 0,5 à 0,8 pour 1 000 naissances et est souvent secondaire au spina bifida, à une hémorragie intracrânienne ou à une étiologie congénitale.1,3 Les autres causes potentielles d’hydrocéphalie comprennent la myélodysplasie, les tumeurs, la méningite, le kyste de la fosse postérieure, la malformation de Dandy-Walker ou la sténose aqueducale.4
La manœuvre mécanique est le traitement principal de l’hydrocéphalie. Les placements de shunt liés à l’hydrocéphalie sont la procédure neurochirurgicale la plus courante chez les enfants, mais ils présentent également le taux d’échec le plus élevé.5 Plus de 40 000 placements de dérivations sont effectués chaque année aux États-Unis, avec un taux de mortalité des patients hospitalisés estimé à 2,7%.5,6 L’introduction de la flore cutanée commune et d’autres agents pathogènes, tant en période opératoire qu’en postopératoire, peut entraîner des infections par shunt et entraîner une défaillance du shunt.
Le taux d’infections par shunt est estimé à 1,6% à 16,7% chez les patients adultes mais jusqu’à 20% chez les patients pédiatriques.2,7 Cette augmentation dans la population pédiatrique serait due à un manque d’immunité (en particulier < 1 an), à une prématurité (< 35 semaines d’âge gestationnel), à une exposition à des agents pathogènes potentiels, à des morbidités concomitantes et à d’autres facteurs physiologiques.3,4 Les patients pédiatriques ont tendance à développer des infections par shunt plus tôt que les adultes, la plupart des infections survenant dans les 30 à 60 premiers jours suivant le placement.1
Les patients âgés de < 5 ans et les adultes âgés de 50 à 59 ans semblent avoir la plus grande incidence d’infections par shunt.1 Les facteurs de risque d’infection par shunt peuvent inclure un âge plus jeune, une fuite de LCR postopératoire, une hémorragie intraventriculaire, des shunts multiples, une chirurgie de révision du shunt au cours des 90 derniers jours, des shunts placés immédiatement après la méningite, un séjour à l’hôpital prolongé (> 1 mois) et une infection par shunt antérieure.2,4,7,8 Les complications liées aux infections par shunt comprennent des dysfonctionnements du shunt, des troubles cognitifs à court ou à long terme, une septicémie, une méningite et un séjour prolongé à l’hôpital.1,4,8
Types de shunts
Les types de shunts les plus courants sont résumés dans le TABLEAU 1. Cet article se concentrera sur les deux shunts les plus utilisés: les shunts ventriculopéritonéaux (VP) et ventriculo-auriculaires (VA). Les shunts VP, les plus courants des deux, agissent en détournant le LCR vers le péritoine, tandis que les shunts VA déplacent le LCR vers l’oreillette du cœur.2,9,10

Pathogenèse des infections par shunt
La contamination par shunt est souvent causée lorsque l’extrémité proximale du shunt entre en contact avec la flore cutanée normale. Cela peut se produire en postopératoire en raison d’une infection de la plaie ou en périopératoire lors de l’implantation chirurgicale.11 bactéries à Gram positif, telles que Staphylococcus epidermidis à coagulase négative et Staphylococcus aureus, sont responsables de 45% à 60% 1-3, 12 et 20% à 33% 2,3 (avec un rapport jusqu’à 80% 4) des infections par shunt, respectivement. Ces agents pathogènes sont étroitement associés à des infections de shunt précoces (survenant dans les 4 semaines suivant la chirurgie de shunt).2
Les infections tardives par shunt peuvent survenir plusieurs mois après la chirurgie par shunt et représentent environ 15% des infections liées au shunt.3 Dans de nombreux cas, ces infections tardives peuvent être causées par des bactéries à gram positif, comme les espèces de Streptocoques ou d’entérocoques, ou des bactéries à gram négatif, le plus souvent Pseudomonas aeruginosa, si le patient a subi une perforation intestinale ou une péritonite (principalement observée dans les shunts VP).2 Les agents pathogènes les plus courants associés aux infections par dérivation sont résumés dans le TABLEAU 2.1- 4,11 Les infections augmentent la probabilité de complications et d’échecs liés au dérivation.

Prévention des infections par shunt
Les méthodes utilisées pour prévenir une infection par shunt comprennent l’utilisation d’une technique stérile, d’antibiotiques systémiques et de cathéters imprégnés d’antibiotiques. Il a été démontré que la technique chirurgicale aseptique aide à réduire le risque d’infections par shunt. Un protocole chirurgical standardisé, comprenant un lavage préopératoire des cheveux du patient avec un shampooing à la chlorhexidine, un double gantage par tous les membres de l’équipe chirurgicale et l’utilisation de shunts imprégnés d’antibiotiques (AIS), mis en œuvre par quatre hôpitaux pour enfants a démontré un taux de réduction des infections de 8,8% à 5,7%.13
Des antibiotiques prophylactiques systémiques peuvent être utilisés pendant la procédure et dans les 24 heures initiales après la mise en place du shunt. Selon une méta-analyse, l’utilisation d’antibiotiques systémiques, prophylactiques et de cathéters imprégnés d’antibiotiques a réduit le taux d’infections par shunt.9 Cette même étude a comparé l’utilisation d’antibiotiques prophylactiques systémiques par rapport au placebo pour réduire l’infection par shunt et a révélé que les antibiotiques diminuaient les taux d’infections par shunt (rapport de cotes, 0,52).9 Alors que l’antibiotique prophylactique le plus approprié pour la mise en place de shunt n’était pas bien défini dans le passé, la plupart des cliniciens utilisent la céfazoline IV ou la vancomycine pour la prophylaxie chirurgicale.2,14 Des lignes directrices récentes recommandent la céfazoline pour les procédures neurochirurgicales de dérivation des fluides, avec la clindamycine et la vancomycine comme alternatives pour les patients allergiques.15
Les cathéters AIS sont couramment utilisés pour prévenir les infections par shunt depuis leur introduction en 200216. La plupart des dispositifs sont imprégnés d’une combinaison de rifampicine et de clindamycine.4,16,17 Ils sont conçus pour cibler la colonisation de bactéries à gram positif qui produisent un biofilm de glycoprotéine qui adhère à la surface du cathéter.16 Une méta-analyse a examiné l’utilisation de cathéters imprégnés d’antibiotiques par rapport aux cathéters standard et a révélé que l’utilisation de cathéters imprégnés d’antibiotiques était associée à une diminution des taux d’infection par shunt (OR, 0,21). Il a été conclu dans cette méta-analyse que l’utilisation d’une prophylaxie antibiotique systémique et de cathéters imprégnés d’antibiotiques pourrait être bénéfique dans la réduction des infections par shunt.9
Un essai rétrospectif a également été mené chez des patients pédiatriques ayant subi une insertion de shunt pendant une période de 3 ans. Pendant les 18 premiers mois, les patients ont reçu des cathéters imprégnés d’antibiotiques; pendant les 18 mois suivants, tout nouveau patient nécessitant un placement de shunt a reçu des cathéters imprégnés d’antibiotiques. Tous les enfants ont été suivis pendant 6 mois après le placement du shunt. Les enfants avec des cathéters non imprégnés d’antibiotiques avaient un taux d’infection de 12%, alors que l’infection n’a été observée que chez 1,4% des enfants avec des cathéters imprégnés d’antibiotiques.18 Un examen plus récent de 15 essais a également conclu que les cathéters à revêtement antibiotique réduisent le taux d’infection clinique, en particulier chez les patients qui ont des cathéters à long terme, ce qui était différent de certaines analyses précédentes.19
Il a été démontré que la prévention des infections par shunt par la prophylaxie et l’utilisation de cathéters AIS réduit le coût des soins aux patients.20 On estime que le coût du traitement d’une infection par dérivation peut varier de 17 300 $ à 48 454 per par patient, ce qui entraîne un coût hospitalier annuel estimé aux États-Unis de 2 milliards de dollars.16,17 Bien que chaque cathéter AIS coûte en moyenne 400 $, le montant d’argent économisé grâce à la prévention de l’infection et/ou de la réinfection peut permettre d’importantes économies à long terme.16 Ces économies sont dues à une probabilité d’infection multipliée par 2,4 et à une diminution du temps passé à l’hôpital à la suite d’une infection. Il a été rapporté que ces économies s’élèveraient à plus de 440 000 $ par 100 patients évités.17
Diagnostic des infections par shunt
Les symptômes généraux de l’infection par shunt comprennent des maux de tête, des nausées, des vomissements, une inflammation du site chirurgical, une anomalie neurologique, de la fièvre et des convulsions.2,3 Les manifestations cliniques des infections par shunt spécifiques au patient dépendent du type de shunt implanté. Les shunts VP peuvent être associés à une péritonite, une anorexie, une irritabilité et des douleurs abdominales8, tandis que les shunts VA peuvent être associés à une septicémie et à une endocardite.2,3 Si des manifestations cliniques telles qu’un état mental altéré, un érythème entourant le site de shunt, un liquide le long de la piste de shunt, un écoulement purulent, un œdème papillaire, une fontanelle bombée, une rigidité nucale ou une fuite évidente de LCR sont observées, le patient doit être évalué avec une analyse du LCR, des hémocultures et une imagerie cérébrale.8
L’analyse du LCR prédictive de l’infection comprend une augmentation du nombre de globules blancs, une augmentation des concentrations de protéines et une diminution des taux de glucose; le LCR doit également être cultivé et coloré en gram. Les hémocultures sont des indicateurs plus utiles des infections par shunt VA par opposition aux infections par shunt VP.11 L’imagerie cérébrale peut être utilisée pour identifier une ventriculite ou des signes d’obstruction du LCR. L’imagerie abdominale peut également être utilisée pour identifier un dysfonctionnement du shunt VP.
Options de traitement
À l’heure actuelle, il n’existe pas de lignes directrices pratiques pour le traitement des infections par shunt; cependant, le retrait du matériel infecté, la mise en place d’un drain ventriculaire externe, les cultures et le traitement par des anti-biotiques intraventriculaires ou intraventriculaires font tous partie d’un processus de prise en charge efficace.2
Les recommandations actuelles pour le traitement empirique de l’infection du système nerveux central (SNC) en présence d’un shunt recommandent l’utilisation de la vancomycine par voie intraveineuse en association avec un agent présentant une couverture gram-négative adéquate, tel que le céfépime, la ceftazidime, le céfotaxime ou le méropénème. La capacité d’un médicament à pénétrer dans le LCR ainsi que l’activité de l’antibiotique contre le biofilm bactérien sont également importantes à considérer pour le choix des antibiotiques.21 Ces agents doivent être administrés jusqu’à ce que l’agent pathogène soit identifié et que le traitement définitif soit déterminé.22,23 Dans un shunt VP, l’extrémité distale du shunt se trouve dans la cavité péritonéale et est plus sensible aux bactéries à gram négatif; la gentamicine peut être ajoutée pour une synergie.2 La thérapie antimicrobienne empirique et les recommandations posologiques pour les infections par shunt sont résumées dans le TABLEAU 3.2,18,22,23
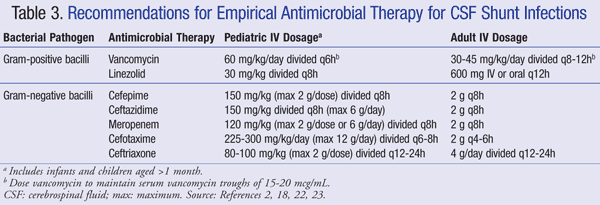
Pour les patients réfractaires au traitement par la vancomycine, il a été démontré que le linézolide à 10 mg / kg toutes les 8 heures était efficace en monothérapie chez les patients pédiatriques.21 L’ajout de rifampine comme traitement d’appoint peut également être envisagé en raison de sa pénétration dans le SNC.24 La durée de l’antibiothérapie dépend en grande partie de l’approche chirurgicale utilisée, du type de shunt et de l’agent pathogène impliqué, une étude faisant état d’une durée de traitement allant de 4 à 47 jours.25,26 Plus précisément, 7 à 10 jours ont été suggérés pour la durée du traitement, 23 avec un traitement plus long (10-14 jours) recommandé pour les infections à gram négatif.2
Dans le cas d’infections par shunt compliquées ou résistantes au traitement, les cliniciens devraient envisager l’administration intrathécale ou intraventriculaire d’antibiotiques pour une efficacité accrue en raison de leur capacité à atteindre des concentrations bactéricides plus élevées dans le SNC.23 La vancomycine et la gentamicine sont couramment utilisées dans cette situation; cependant, il n’y a pas de recommandations définitives sur leur utilisation.22,23
Infections fongiques par shunt
Une infection fongique par shunt est considérée comme rare, une étude ayant rapporté un taux d’incidence de 0,01%.27 Les agents pathogènes les plus courants responsables d’une infection fongique par shunt sont les espèces de Candida (y compris C albicans, C parapsilosis et C tropicalis), qui causent 75% des cas fongiques. D’autres organismes comprennent les espèces d’Histoplasmose, Cryptococcus neoformans et Aspergillus. Le traitement principal des infections fongiques par shunt est l’amphotéricine B liposomale de 3 à 5 mg / kg / jour pendant au moins 12 semaines.27 Pour les patients intolérants à l’amphotéricine B, la 5-flucytosine peut être une alternative.28 Ceci est souvent suivi d’un traitement par fluconazole 600 à 800 mg/jour ou par itraconazole 200 mg deux à trois fois par jour pendant 1 an maximum chez les patients immunocompétents et d’un traitement potentiellement à vie chez les patients immunodéprimés.27
Conclusion
Les infections par shunt sont un facteur de risque associé au traitement par hydrocéphalie. La prévention de l’infection a été démontrée avec des antibiotiques empiriques et l’utilisation de cathéters AIS, associés à une technique aseptique appropriée, pour diminuer de manière significative le taux d’infection et réduire le risque de séquelles comorbides. Il n’existe actuellement aucune ligne directrice pour le traitement des infections par shunt; cependant, un traitement empirique IV impliquant une couverture à gram positif et à gram négatif, comme la vancomycine et une céphalosporine de troisième génération, serait recommandé. Des antibiotiques intraventriculaires peuvent également être nécessaires pour une concentration maximale bactéricide du SNC.
1. Langley JM, Gravel D, Moore D et coll. Étude des infections associées au shunt du liquide céphalo-rachidien au cours de la première année suivant le placement, par la Surveillance canadienne des infections nosocomiales. Infecter l’Épidémiol Hospitalier de contrôle. 2009;30:285-288.
2. Wells DL, Allen JM. Infections par shunt ventriculopéritonéal chez les patients adultes. Soins critiques AACN Adv. 2013;24:6-12.
3. Lee JK, Seok JY, Lee JH et coll. Incidence et facteurs de risque des infections par shunt ventriculopéritonéal chez les enfants: une étude de 333 shunts consécutifs en 6 ans. J Coréen Med Sci. 2012;27:1563-1568.
4. Les résultats de cette étude sont les suivants : Comparison of shunt infection incidence in high-risk subgroups receiving antibiotic-impregnated versus standard shunts. Enfants Nerv Syst. 2009;25:77-83.
5. Traitement de l’hydrocéphalie. Association d’hydrocéphalie. www.hydro-Québec.org / hydrocéphalie-éducation et soutien / apprentissage de l’hydrocéphalie / traitement de l’hydrocéphalie /. Consulté le 11 février 2014.
6. Patwardhan RV, Nanda A. shunts ventriculaires implantés aux États-Unis: le coût d’un milliard de dollars par an du traitement de l’hydrocéphalie. Neurochirurgie. 2005;56:139-144.
7. Dallacasa P, Dappozzo A, Galassi E, et al. Infections par dérivation du liquide céphalo-rachidien chez les nourrissons. Enfants Nerv Syst. 1995;11:643-648.
8. Rogers EA, Kimia A, Madsen JR, et coll. Prédicteurs de l’infection par shunt ventriculaire chez les enfants se présentant à un service d’urgence pédiatrique. Soins pédiatriques Emerg. 2012;28:405-409.
9. Ratilal BO, Costa J, Sampaio C. Prophylaxie antibiotique pour l’introduction chirurgicale de shunts ventriculaires intracrâniens. Cochrane Database Syst Rév. 2006; (3) : CD005365.
10. Systèmes de dérivation. Association d’hydrocéphalie. www.hydroassoc.org/hydrocephalus-education-and-support/learning-about-hydrocephalus/shunts . Consulté le 12 février 2014.
11. Avant KR, Moins de HD, Plus de HG. Infection par shunt du liquide céphalo-rachidien. Un examen de 35 infections chez 32 patients. J Neurochirurgie. 1983;59:389-394.
12. Lan CC, Wong TT, Chen SJ, et al. Diagnostic précoce des infections et des dysfonctionnements du shunt ventriculopéritonéal chez les enfants atteints d’hydrocéphalie. J Microbiol Immunol Infecter. 2003;36:47-50.
13. Kestle JR, Riva-Cambrin J, Wellons JC, et al. Un protocole normalisé pour réduire l’infection par dérivation du liquide céphalo-rachidien : l’Initiative d’amélioration de la qualité du Réseau de recherche clinique sur l’hydrocéphalie. J Neurochirurgie Pédiatrique. 2011;8:22-29.
14. Shah SS, Sinkowitz-Cochran RL, Keyserling HL, et al. Utilisation de la vancomycine chez les patients en neurochirurgie pédiatrique. J’Infecte Le Contrôle. 1999;27:482-487.
15. Bratzler DW, Dellinger EP, Olsen KM, et al. Lignes directrices de pratique clinique pour la prophylaxie antimicrobienne en chirurgie. Am J Santé – Syst Pharm. 2013;70:195-283.
16. Parker SL, Anderson WN, Lilienfeld S, et coll. Infection par shunt céphalo-rachidien chez les patients recevant des shunts imprégnés d’antibiotiques par rapport aux shunts standard. J Neurochirurgie Pédiatrique. 2011;8:259-265.
17. Attenello F, Garces-Ambrossi G, Zaidi H, et al. Coûts hospitaliers associés aux infections par shunt chez les patients recevant des cathéters de shunt imprégnés d’antibiotiques par rapport aux cathéters de shunt standard. Neurochirurgie. 2010;66:284-289.
18. Sciubba DM, Stuart RM, McGirt MJ, et coll. Effet des cathéters de shunt imprégnés d’antibiotiques dans la diminution de l’incidence de l’infection par shunt dans le traitement de l’hydrocéphalie. J Neurochirurgie. 2005; 103 (suppl): 131-136.
19. Babu MA, Patel R, Marsh WR, et al. Stratégies pour diminuer le risque d’infections par cathéter ventriculaire: examen des preuves. Soins Neurocrit. 2012;16:194-202.
20. Bratzler DW, Dellinger EP, Olsen KM, et al. Lignes directrices de pratique clinique pour la prophylaxie antimicrobienne en chirurgie. Surg Infect (Larchmt). 2013;14:73-156.
21. Yilmaz A, Dalgic N, Musluman M, et al. Traitement par linézolide des infections du liquide céphalo-rachidien liées au shunt chez les enfants. J Neurochirurgie Pédiatrique. 2010;5:443-448.
22. Tunkel AR, Hartman BJ, Kaplan SL, et al. Directives pratiques pour la prise en charge de la méningite bactérienne. Clin Infecte Dis. 2004;39:1267-1284.
23. Van de Beek D, Drake JM, Tunkel AR. Méningite bactérienne nosocomiale. En anglais J Med. 2010;362:146-154.
24. Hedberg A, Hardemark HG, Olsson-Liljequist B, et al. Pénétration de l’acide fusidique et de la rifampicine dans le liquide céphalo-rachidien dans la méningite inflammatoire de bas grade causée par Staphylococcus epidermidis. Le Microbiol Clin Infecte. 2004;10:765-768.
25. Prophylaxie antimicrobienne pour la chirurgie. Traiter Guidel Med Lett. 2004;2:27-32.
26. Simon TD, Hall M, Dean JM, et coll. Réinfection après une infection initiale par shunt du liquide céphalo-rachidien. J Neurochirurgie Pédiatrique. 2010;6:277-285.
27. V. A., Ludwig C., Camara-Quintana JQ, et coll. Infection fongique d’un shunt ventriculopéritonéal: diagnostic et traitement de l’histoplasmose. Neurochirurgie mondiale. 2013;80:222.e5-e13.
28. Chiou CC, Wong TT, Lin HH, et al. Infection fongique des shunts ventriculopéritonéaux chez les enfants. Clin Infecte Dis. 1994;19:1049-1053.