US Pharm. 2006;7:58-68.
L’insufficienza cardiaca è un grave problema di salute negli Stati Uniti. Circa cinque milioni di persone hanno insufficienza cardiaca, e 550.000 pazienti sono diagnosticati con insufficienza cardiaca ogni anno.1,2 L’insufficienza cardiaca è generalmente caratterizzata come una malattia degli anziani; circa l ‘ 80% dei pazienti ospedalizzati con insufficienza cardiaca ha più di 65 anni. Pertanto, l’incidenza di insufficienza cardiaca dovrebbe crescere man mano che la popolazione invecchia.2 I ricoveri correlati all’insufficienza cardiaca sono aumentati di circa il 25%, a più di un milione, tra il 1990 e il 1999. Nel 2001, l’insufficienza cardiaca ha causato direttamente 53.000 morti. Le morti correlate all’insufficienza cardiaca sono aumentate negli ultimi anni, il che può essere attribuito ad un aumento della sopravvivenza da precedenti eventi cardiovascolari.
L’insufficienza cardiaca è una sindrome clinica in cui si verificano cambiamenti funzionali o strutturali nel cuore, con conseguente sintomi clinici come dispnea, affaticamento, limitata tolleranza all’esercizio, congestione polmonare ed edema periferico.1-3 Molti fattori di rischio noti, come la malattia coronarica (CAD), il diabete, l’obesità, l’ipertensione e la storia familiare di cardiomiopatie, sono associati all’insorgenza e alla progressione verso l’insufficienza cardiaca (Tabella 1).4 Inoltre, la cardiopatia valvolare è ancora una causa comune di insufficienza cardiaca. Ipertensione precede insufficienza cardiaca circa il 90% del tempo e aumenta il rischio di un paziente di insufficienza cardiaca triplice.5 CAD è la causa più comune di insufficienza cardiaca sistolica. Infarto miocardico (MI) rappresenta insufficienza cardiaca sistolica in quasi il 70% dei pazienti. Altre eziologie associate a disfunzione sistolica e insufficienza cardiaca includono cardiomiopatie dilatate e ipertrofia ventricolare.2,4

Fisiopatologia
L’insufficienza cardiaca sistolica è associata a compromissione della contrattilità ventricolare sinistra che si traduce in gittata cardiaca inefficiente, specialmente durante lo sforzo. L’insufficienza cardiaca di solito inizia con qualche lesione o stress sul miocardio che si traduce in un cambiamento nella struttura del cuore; questo è noto come rimodellamento cardiaco. Il rimodellamento cardiaco precede l’insorgenza dei sintomi di mesi o addirittura anni. Mentre la dilatazione cambia il ventricolo ad una forma più sferica, gli sforzi emodinamici cominciano ad aggiungere lo sforzo sulle pareti del ventricolo difettoso, piombo alla funzione meccanica depressa ed al flusso aumentato di rigurgitant attraverso la valvola mitrale.1-3
Il sistema neurormonale ha un ruolo attivo nell’accelerazione del rimodellamento cardiaco. I pazienti con insufficienza cardiaca hanno aumentato i livelli di noradrenalina, angiotensina II, aldosterone, endotelina, vasopressina e citochine. L’attivazione del sistema renina-angiotensina-aldosterone aumenta la vasocostrizione periferica, con conseguente aumento del postcarico e del rimodellamento cardiaco. Inoltre, l’attivazione del sistema nervoso simpatico provoca tachicardia, portando ad un aumento della domanda di ossigeno miocardico. L’aumento della domanda di ossigeno cardiaco senza cambiamenti nell’offerta può causare un aumento dell’ischemia miocardica e un ulteriore rimodellamento cardiaco. I neurormoni possono esercitare effetti cardiotossici sulle cellule, che possono modificare ulteriormente l’architettura e le prestazioni del cuore.2
Presentazione clinica
L’insufficienza cardiaca sistolica è una sindrome diagnosticata sulla base di dati raccolti da un’accurata anamnesi del paziente, inclusa una valutazione della sintomatologia e dei risultati fisici. La maggior parte dei pazienti si presenta in uno dei tre modi: con ridotta tolleranza all’esercizio, con ritenzione di liquidi o senza sintomi.2,6 Dispnea da sforzo e mancanza di respiro sono i sintomi cardinali dell’insufficienza cardiaca. All’esame fisico possono essere presenti edema periferico, congestione polmonare o entrambi i sintomi.2
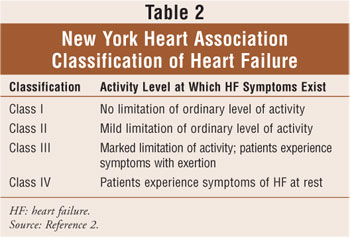
La classificazione dell’insufficienza cardiaca si basa sulla combinazione dei quattro stadi di insufficienza cardiaca dell’American College of Cardiology/American Heart Association (Tabella 1), che vanno dal rischio di disfunzione cardiaca (stadio A) all’insufficienza cardiaca refrattaria (stadio D) e sulle linee guida della New York Heart Association (NYHA).2,6 La classificazione NYHA è il metodo più comunemente usato per quantificare il grado di limitazione funzionale imposta dall’insufficienza cardiaca (Tabella 2). Nel complesso, la classificazione funzionale dell’insufficienza cardiaca tende a diminuire nel tempo a causa della progressione del rimodellamento cardiaco.2
Il singolo test diagnostico più utile è l’ecocardiogramma bidimensionale completo, che viene utilizzato insieme agli studi sul flusso Doppler per determinare se vi sono anomalie strutturali e funzionali nel cuore. L’ecocardiogramma transtoracico (TTE) è uno studio ecografico non invasivo che produce immagini del cuore usando le onde sonore. Fornisce informazioni sulla stima della frazione di eiezione ventricolare sinistra( LVEF), dimensioni e volumi ventricolari, volumi della parete, geometria della camera cardiaca e movimento della parete regionale. Nei pazienti con insufficienza cardiaca sistolica, la LVEF è solitamente inferiore al 40%.2 Altri studi utilizzati in combinazione con il TTE per valutare l’eziologia, la gravità e i potenziali effetti del trattamento correlati al farmaco nell’insufficienza cardiaca includono la radiografia del torace al basale, l’elettrocardiografia a 12 conduttori e le misure del peptide natriuretico cerebrale, degli elettroliti sierici e della funzione renale. Questi studi sono importanti perché gli operatori sanitari possono usarli come linea di base per determinare se un paziente ha subito un cambiamento nello stato clinico.2,6
GESTIONE DELL’INSUFFICIENZA CARDIACA SISTOLICA
Nonfarmacologica
Controllare i fattori di rischio come ipertensione, diabete mellito, dislipidemie, malattie vascolari aterosclerotiche e disturbi della tiroide può rallentare la progressione dell’insufficienza cardiaca e del rimodellamento cardiaco.2,4,6 Pazienti con insufficienza cardiaca devono ricevere i vaccini antinfluenzali e pneumococcici per ridurre il rischio di comorbidità come le infezioni respiratorie.2 Il fattore di rischio modificabile più significativo sarebbe comportamenti ad alto rischio come il fumo, l’alcol e l’uso illecito di droghe.2,7
Restrizione di sodio (?2 grammi/giorno) aiuta nella riduzione del sovraccarico di volume e può diminuire l’uso di diuretici. Inoltre, la pesatura giornaliera consente ai pazienti di valutare lo stato del volume, su cui può essere basato l’aggiustamento del dosaggio diuretico. Tuttavia, nessuno studio ha esaminato l’effetto della restrizione dietetica del sodio sulla morbilità o sulla mortalità.7,8 L’attività fisica ha dimostrato di ridurre la mortalità e le ospedalizzazioni per i pazienti con insufficienza cardiaca stabile. La restrizione dell’esercizio promuove il decondizionamento fisico, che può contribuire all’intolleranza all’esercizio di un paziente. Infine, il rispetto della dieta e del regime terapeutico terapeutico ha un ruolo significativo nella prevenzione dei ricoveri acuti.2,7
Farmacologico
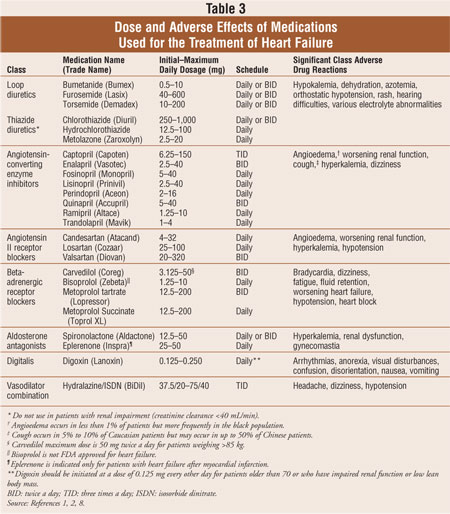
La maggior parte dei pazienti con insufficienza cardiaca è gestita con una combinazione standard di tre farmaci: un diuretico dell’ansa, un inibitore dell’enzima di conversione dell’angiotensina (ACE) o un bloccante del recettore dell’angiotensina II (ARB) e un bloccante del recettore beta-adrenergico.1,2 Diuretici sono il pilastro per la riduzione dei sintomi di sovraccarico di volume nello scompenso cardiaco, mentre ACE inibitori, ARB e beta-bloccanti hanno dimostrato di ridurre la morbilità e la mortalità.2 Gli antagonisti dell’aldosterone sono indicati come terapia aggiuntiva per i pazienti con insufficienza cardiaca sintomatica di classe NYHA III o IV o dopo infarto miocardico acuto precoce in pazienti con ridotta funzionalità ventricolare sinistra e evidenza clinica di insufficienza cardiaca. Se i pazienti continuano ad essere sintomatici, la digossina può essere aggiunta al regime farmacologico standard per ridurre i sintomi, diminuire i ricoveri e migliorare la tolleranza all’esercizio. I farmaci usati per trattare l’insufficienza cardiaca sono discussi nella Tabella 3. Le modifiche dello stile di vita e le terapie farmacologiche per l’insufficienza cardiaca sistolica sono progettate per ridurre la morbilità e la mortalità, prevenire la progressione del rimodellamento cardiaco e migliorare la qualità della vita dei pazienti.2
Diuretici:Il pilastro del trattamento sintomatico del sovraccarico di volume nell’insufficienza cardiaca, i diuretici riducono la ritenzione di liquidi che causa congestione polmonare, edema periferico, distensione venosa giugulare e/o aumento del peso corporeo. I diuretici dell’ansa che agiscono nel ciclo di Henle aumentano l’escrezione di sodio sierico del 20% al 25%, aumentano l’eliminazione dell’acqua libera e mantengono la loro efficacia nei pazienti con insufficienza renale.1,2 Al contrario, i diuretici tiazidici riducono l’escrezione di sodio del 5% al 10%, aumentano l’eliminazione dell’acqua libera e perdono la loro efficacia nei pazienti con malattia renale cronica (clearance della creatinina <40 ml/min). I diuretici dell’ansa sono gli agenti preferiti per il trattamento dell’insufficienza cardiaca, ma i tiazidici possono essere utilizzati in pazienti con lieve ritenzione di liquidi e ipertensione. I diuretici, così come gli ACE-inibitori e i beta-bloccanti, sono raccomandati per l’uso in tutti i pazienti con insufficienza cardiaca in stadio C.2 Studi hanno dimostrato che i diuretici migliorano la funzione cardiaca, i sintomi e l’intolleranza all’esercizio nei pazienti con insufficienza cardiaca. Tuttavia, gli effetti a lungo termine dei diuretici sulla mortalità non sono noti.1,2,8
ACE Inibitori: gli ACE inibitori riducono l ‘attività del sistema renina-angiotensina-aldosterone bloccando la conversione dell’ angiotensina I in angiotensina II, prevenendo la vasocostrizione indotta dall ‘ angiotensina II. Inoltre inibiscono il rilascio di aldosterone, portando ad una diminuzione della ritenzione di sodio e liquidi. Questi effetti combinati riducono sia il precarico che il postcarico e rallentano la progressione del rimodellamento cardiaco.Gli ACE-inibitori 1,2 possono anche avere attività aggiuntiva con chinine migliorate e produzione di prostaglandine mediate dalla chinina.2 Oltre 30 studi clinici controllati che valutano l’efficacia degli ACE-inibitori hanno dimostrato che gli ACE-inibitori riducono il rischio di morte e il rischio combinato di morte e ospedalizzazioni. A tutti i pazienti con insufficienza cardiaca sistolica ventricolare sinistra deve essere somministrato un ACE inibitore a meno che non sia controindicato (angioedema, stenosi bilaterale dell’arteria renale, potassio sierico >5,5 mEq/L, gravidanza, ipotensione sintomatica o insufficienza renale instabile). Gli ACE-inibitori devono essere iniziati a basse dosi e lentamente titolati in base alla tollerabilità degli effetti avversi.1,2,8
ARBs: Rispetto agli studi sugli ACE-inibitori, meno studi clinici hanno studiato l’uso di ARBs in pazienti con insufficienza cardiaca; pertanto, questi agenti sono riservati ai pazienti con intolleranza dimostrata agli ACE-inibitori. Gli ARB bloccano selettivamente l ‘angiotensina II legandosi al recettore dell’ angiotensina. Le ARB riducono la gravità delle reazioni avverse alla chinina, come tosse e angioedema, sebbene sia stato riportato angioedema con questi agenti. L’aggiunta di un ARB alla terapia standard incluso un ACE inibitore può ridurre le dimensioni del ventricolo sinistro e il numero di ricoveri, ma l’evidenza è insufficiente nella riduzione della mortalità.2,8 Uno studio ha mostrato che candesartan aggiunto ad un ACE inibitore ha ridotto le morti cardiovascolari.Tuttavia, un altro studio condotto su valsartan in pazienti con infarto miocardico e insufficienza cardiaca non ha dimostrato alcun beneficio da valsartan e da un ACE inibitore somministrati insieme rispetto ad un ACE inibitore da solo.10 La prescrizione di una combinazione di ACE-inibitori, ARB e antagonisti dell’aldosterone non è raccomandata a causa del rischio di iperkaliemia. Gli ARBs rimangono un’alternativa agli ACE-inibitori nel trattamento dell’insufficienza cardiaca.2
Bloccanti dei recettori beta-adrenergici: tre tipi di beta-bloccanti hanno dimostrato di ridurre la mortalità: metoprololo a rilascio prolungato e bisoprololo, che bloccano selettivamente i recettori beta-1 e carvedilolo, che blocca i recettori alfa-1, beta-1 e beta-2.1,2,8 In confronto, uno studio ha dimostrato che il metoprololo a breve durata d’azione ha avuto meno effetto rispetto al carvedilolo, ma la dose di metoprololo utilizzata era inferiore alla dose target raccomandata.11 Oltre alla terapia standard, i beta-bloccanti hanno mostrato una riduzione combinata della morte e del ricovero in ospedale per insufficienza cardiaca. I beta-bloccanti inibiscono gli effetti avversi del sistema nervoso simpatico, superando gli effetti inotropi negativi.2 Nel complesso, i beta-bloccanti devono essere iniziati a dosi molto basse, titolati lentamente ad intervalli di almeno due settimane e non bruscamente ritirati, a causa del rischio di peggioramento dello scompenso cardiaco e dello scompenso acuto.1,2
Antagonisti dell’aldosterone: gli antagonisti dell’aldosterone bloccano il recettore dell’aldosterone nel tubulo distale del nefrone, con conseguente ritenzione di potassio, escrezione di sodio e diuresi lieve. Gli antagonisti dell’aldosterone sono raccomandati nei pazienti con insufficienza cardiaca moderatamente grave o grave e scompenso recente o in quelli con disfunzione ventricolare sinistra subito dopo un infarto miocardico.2 Quando spironolattone a basse dosi è stato aggiunto a un ACE inibitore in pazienti con insufficienza cardiaca NYHA classe III e IV, i pazienti hanno avuto una riduzione del 30% della mortalità per tutte le cause.12 Un altro studio ha mostrato che eplerenone ha portato ad una riduzione della mortalità nei pazienti con LVEF inferiore al 40% entro 14 giorni dall’IM, sebbene non vi siano dati sull’uso di eplerenone nel trattamento dell’insufficienza cardiaca correlata a cause diverse dall’IM.13 Il fattore limitante più importante degli antagonisti dell’aldosterone è l’iperkaliemia potenzialmente pericolosa per la vita.2,14 L’iperkaliemia aumenta progressivamente quando la creatinina sierica supera 1,6 mg / dL, anche se gli studi hanno esaminato antagonisti dell’aldosterone in pazienti con creatinina sierica entry-level da 2,0 a 2,5 mg / dL. Inoltre, gli antagonisti dell’aldosterone devono essere evitati nei pazienti con potassio sierico superiore a 5,0 mEq per litro.2
Digossina: La digossina è un glicoside cardiaco che lavora per aumentare la contrattilità del cuore inibendo la pompa dell’adenosina trifosfatasi sodio-potassio (ATPasi), aumentando così il calcio intracellulare. La digossina è raccomandata per il controllo sintomatico in pazienti con insufficienza cardiaca da lieve a moderata classe NYHA II o III.2 In un’analisi post hoc, le concentrazioni sieriche di digossina comprese tra 0,5 e 0,9 ng/mL hanno ridotto i ricoveri; tuttavia, concentrazioni superiori a 1 ng/mL sono state associate a una tendenza verso un aumento della mortalità rispetto al placebo.15 Mentre gli studi non hanno dimostrato che la digossina riduce la mortalità, questo agente può migliorare i sintomi e l’intolleranza all’esercizio fisico, ridurre i ricoveri e migliorare la qualità generale della vita.2,8,16
Combinazione vasodilatatore: La raccomandazione di idralazina e isosorbide dinitrato (ISDN) in combinazione è riservata ai pazienti che hanno dimostrato incapacità di tollerare un ACE inibitore o ARB. Tuttavia, in un recente studio che ha coinvolto una coorte di pazienti afroamericani con insufficienza cardiaca sintomatica NYHA III o IV, l’aggiunta di idralazina e combinazione ISDN alla terapia standard (cioè ACE-inibitore, diuretico e beta-bloccante) ha portato ad un miglioramento del 43% della sopravvivenza e una riduzione del 33% del rischio del primo ricovero in ospedale rispetto al placebo.17 In teoria, la combinazione di idralazina e ISDN può aumentare la biodisponibilità dell’ossido nitrico.2 La combinazione ISDN e hydralazine (BiDil) è approvata dalla FDA solo per gli afro-americani come terapia aggiuntiva alla terapia standard di insufficienza cardiaca.18 L’idralazina è un vasodilatatore delle arteriole, che agisce per diminuire il postcarico, mentre l’ISDN è un vasodilatatore venoso, che agisce per diminuire il precarico. Questa combinazione di vasodilatatori non è preferita rispetto agli ACE-inibitori o ARB, poiché può avere effetti avversi intollerabili come mal di testa o vertigini e problemi di conformità come le dosi perse, ma può essere utilizzata come terapia aggiuntiva per la popolazione afro-americana.2
Medicinali alternativi: le foglie di biancospino con fiori, note anche come estratto di Crataegus, sono state sostenute per insufficienza cardiaca lieve (NYHA II). Attraverso studi in vitro, le foglie di biancospino hanno dimostrato effetti inotropi positivi, proprietà vasodilatatrici e aumento del flusso sanguigno coronarico. Gli studi hanno mostrato un miglioramento dei sintomi soggettivi nei pazienti con insufficienza cardiaca lieve. A causa degli effetti simili alla digitale, i pazienti che assumono sia l’estratto di Crataegus che la digitale devono essere attentamente monitorati. Gli effetti indesiderati riportati sono stati sintomi gastrointestinali, palpitazioni, dolore toracico e vertigini.19,20
Un’altra medicina alternativa che è stata utilizzata nel trattamento dell’insufficienza cardiaca è coenyzme Q10, una vitamina liposolubile. Alcuni studi hanno dimostrato che il coenzima Q10 ha portato a un miglioramento della frequenza di ospedalizzazioni, dispnea ed edema.21 Tuttavia, uno studio randomizzato, in doppio cieco, controllato con placebo non ha dimostrato alcuna differenza tra coenyzme Q10 e placebo in LVEF, tolleranza all’esercizio o consumo di ossigeno di picco nei pazienti con insufficienza cardiaca.22 Gli effetti avversi documentati del coenzima Q10 sono stati disturbi gastrointestinali, ipoglicemia e ipotensione.Sono in corso 21 studi clinici controllati su estratto di Crataegus e coenyzme Q10 per valutare l’efficacia e la sicurezza nel trattamento dell’insufficienza cardiaca.20,21
FARMACI NOCIVI NELL’INSUFFICIENZA CARDIACA
Diverse classi di farmaci possono esacerbare l’insufficienza cardiaca e dovrebbero essere evitate. Gli agenti antiaritmici, ad eccezione di amiodarone o dofetilide, possono causare un effetto cardiodepressivo e proaritmico sul cuore, portando a scompenso acuto.1,2 Calcio-antagonisti di prima generazione sono stati associati ad un aumento degli eventi cardiovascolari e ad un peggioramento dell ‘ insufficienza cardiaca. I nuovi bloccanti dei canali del calcio a lunga durata d’azione amlodipina e felodipina sembrano essere sicuri, ma nessuno studio ha dimostrato una riduzione statisticamente significativa della mortalità.2,8,23 I tiazolidinedioni sono stati associati ad aumento di peso e ritenzione di liquidi, che possono portare ad insufficienza cardiaca o precipitare una riacutizzazione acuta di insufficienza cardiaca. Tuttavia, l’edema è più probabile che si verifichi quando i tiazolidinedioni sono usati in combinazione con la terapia insulinica.24,25 Pertanto, i tiazolidinedioni non sono raccomandati nei pazienti con diabete mellito e insufficienza cardiaca di classe III o IV NYHA.25-27 FANS causano ritenzione di sodio e vasocostrizione periferica, precipitando un’esacerbazione acuta di insufficienza cardiaca. Inoltre, riducono l’efficacia e aumentano il rischio di tossicità da ACE-inibitori e diuretici. Esiste la possibilità di un’interazione farmacologica quando l’aspirina viene utilizzata in combinazione con ACE-inibitori, ma rimane controversa e richiede ulteriori studi.2
RUOLO DEL FARMACISTA
Una comprensione dei benefici della terapia farmacologica nell’insufficienza cardiaca può portare a cure farmaceutiche ottimali. I farmacisti possono aiutare i pazienti a identificare e alleviare comportamenti ad alto rischio come il fumo, il consumo di alcol e l’uso illecito e dannoso di droghe OTC. Inoltre, i farmacisti devono monitorare i pazienti per la progressione dello stato di malattia, compresi segni e sintomi di insufficienza cardiaca, e incoraggiare i pazienti a tracciare il loro peso.
Incoraggiare i pazienti ad aderire a restrizioni dietetiche, linee guida di esercizio e regimi di farmaci per l’insufficienza cardiaca dovrebbe essere la priorità di un farmacista. La non aderenza ai farmaci terapeutici è stata associata ad un aumento della mortalità e può essere correlata agli effetti collaterali negativi dei farmaci. I farmacisti dovrebbero monitorare e incoraggiare i pazienti a essere conformi ai loro farmaci per ridurre la mortalità. Monitorando e istruendo i pazienti e gli altri operatori sanitari sugli effetti avversi correlati ai farmaci, i farmacisti possono contribuire ad aumentare la conformità ai farmaci. Inoltre, i farmacisti devono essere consapevoli delle alternative ai farmaci come gli ACE-inibitori e discutere con altri operatori sanitari i benefici della mortalità ad essi associati al fine di fornire cure farmaceutiche ottimali e ridurre il rischio di mortalità.
I pazienti e gli operatori sanitari potrebbero non essere a conoscenza dell’associazione tra farmaci comuni e esacerbazioni di insufficienza cardiaca. Poiché alcuni farmaci OTC comuni, inclusi i FANS, sono controindicati nei pazienti con insufficienza cardiaca, educare il paziente sul perché lui o lei non dovrebbe assumere questi farmaci è un altro ruolo vitale per i farmacisti. I farmacisti devono monitorare i pazienti e consultarsi con gli operatori sanitari e i pazienti sulle interazioni dannose tra farmaci e farmaci che possono causare il ricovero in ospedale.
1. Klein L, O’Connor CM, Gattis WA, et al. Terapia farmacologica per pazienti con insufficienza cardiaca cronica e ridotta funzione sistolica: revisione delle prove e considerazioni pratiche. Sono J Cardiol. 2003; 91 (suppl): 18F-40F.
2. Hunt SA, Abraham WT, Chin MH, et al. ACC / AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). American College di Cardiologia Sito Web. Disponibile presso: www.acc.org/clinical/guidelines/failure//index.pdf.
3. Francis GS, Gassler JP, Sonnenblick EH. Fisiopatologia e diagnosi di insufficienza cardiaca. In: Fuster V, et al, eds. Hurst è il cuore. 10a ed. New York, NY: McGraw-Hill; 2001: 655-686.
4. I dati raccolti sono Prevenzione e gestione dell’insufficienza cardiaca cronica nei pazienti a rischio. Sono J Cardiol. 2003; 91 (suppl): 10F-17F.
5. Chobanian AV, Bakris GL, Nero HR, et al. Settimo rapporto del Comitato nazionale congiunto per la prevenzione, il rilevamento, la valutazione e il trattamento della pressione alta. Ipertensione. 2003;42:1206-1252.
6. Frigerio M, Oliva F, Turazza FM, Bonow RO. Prevenzione e gestione dell’insufficienza cardiaca cronica nella gestione di pazienti asintomatici. Sono J Cardiol. 2003; 91 (suppl): 4F-9F.
7. Colonna P, Sorino M, D’Agostino C, et al. Cura nonfarmacologica dell’insufficienza cardiaca: consulenza, restrizione dietetica, riabilitazione, trattamento dell’apnea notturna e ultrafiltrazione. Sono J Cardiol. 2003; 91 (suppl): 41F-50F.
8. McConaghy JR, Smith SR. Trattamento ambulatoriale dell’insufficienza cardiaca sistolica. Am Fam Medico. 2004;70:2157-2164.
9. Il giovane JB, Dunlap ME, Pfeffer MA, et al. Riduzione della mortalità e della morbilità con candesartan in pazienti con insufficienza cardiaca cronica e disfunzione sistolica ventricolare sinistra: risultati degli studi CHARM low-left ventricular ejection fraction. Circolazione. 2004;110:2618-2626.
10. Cohn JN, Tognoni G. Uno studio randomizzato del valsartan bloccante del recettore dell’angiotensina nell’insufficienza cardiaca cronica. N Ingl J Med. 2001;345:1667-1675.
11. I nostri servizi sono a vostra disposizione. Confronto tra carvedilolo e metoprololo sugli esiti clinici in pazienti con insufficienza cardiaca cronica nello studio europeo carvedilolo o metoprololo (COMET): studio controllato randomizzato. Lancet. 2003;362:7-13.
12. Pitt B, Zannad F, Remme WJ, et al. L’effetto di spironolattone su morbilità e mortalità in pazienti con insufficienza cardiaca severa. N Ingl J Med. 1999;341:709-717.
13. Pitt B, Remme W, Zannad F, et al. Eplerenone, un bloccante selettivo dell’aldosterone, in pazienti con disfunzione ventricolare sinistra dopo infarto miocardico. N Ingl J Med. 2003;348:1309-1321.
14. Aldattone . Chicago, IL: Pharmacia Corporation; Luglio 2003.
15. Ahmed A, Rich MW, Amore TE, et al. Digossina e riduzione della mortalità e ospedalizzazione nell’insufficienza cardiaca: un’analisi post hoc completa dello studio DIG. Eur Cuore J. 2006;27:178-186.
16. Il Digitalis Investigation Group. L’effetto della digossina sulla mortalità e sulla morbilità nei pazienti con insufficienza cardiaca. N Ingl J Med. 1997;336:525-533.
17. Taylor AL, Ziesche S, Yancy C, et al. Combinazione di isosorbide dinitrato e idralazina nei neri con insufficienza cardiaca. N Ingl J Med. 2004;351:2049-2057.
18. BiDil . Lexington, MAMMA: Nitromed Inc.; Agosto 2005.
19. De Smet PA. Rimedi erboristici. N Ingl J Med. 2002;347:2045-2056.
20. Holubarsch CJ, Colucci WS, Meinertz T, et al. Sopravvivenza e prognosi: indagine sull’estratto di Crataegus WS 1442 nell’insufficienza cardiaca congestizia(SPICE) – logica, progettazione dello studio e protocollo di studio. Eur J cuore fallire. 2000;2:431-437.
21. Bonadkar RA, Guarneri E. Coenzima Q10. Am Fam Medico. 2005;72:1065-1070.
22. Khatta M, Alexander BS, Krichten CM, et al. L’effetto di coenyzme Q10 in pazienti con insufficienza cardiaca congestizia. Ann Stagista Med. 2000;132:636-640.
23. De Vries RJM, Van Veldhuisen DJ, Dunselman PHJM. Efficacia e sicurezza dei bloccanti dei canali del calcio nell’insufficienza cardiaca: focus su recenti studi con diidropiridine di seconda generazione. Am Cuore J. 2000;139: 185-194.
24. Delea TE, Edelsberg JS, Hagiwara M, et al. Uso di tiazolidinedioni e rischio di insufficienza cardiaca nelle persone con diabete di tipo 2. Cura del diabete. 2003;26:2983-2989.
25. Hollenberg NK. Considerazioni per la gestione dei problemi fluidodinamici associati ai tiazolidinedioni. Sono J Med. 2003; 115:111S-115S.
26. Avandia . Research Triangle Park, NC: GlaxoSmithKline; Agosto 2005.
27. Actos . La nostra azienda si occupa di: ; Agosto 2004.
Per commentare questo articolo, contattare [email protected].